O nitrato de potássio (KNO3) é um sal cristalino branco frequentemente usado em fertilizantes, preservação de alimentos e fogos de artifício. É também um ingrediente chave em alguns cremes dentais para dentes sensíveis.
| Nome IUPAC | Nitrato de potássio |
| Fórmula molecular | KNO3 |
| Número CAS | 7757-79-1 |
| Sinônimos | salitre; nitrato de potássio; nitro; salitre; E252; Salitre chinês; ácido nítrico, sal de potássio; Nitras de Kalii |
| InChI | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Propriedades do nitrato de potássio
Fórmula de nitrato de potássio
A fórmula química do nitrato de potássio é KNO3. Esta fórmula mostra que o composto é composto por um íon potássio, um íon nitrato e três íons oxigênio. A fórmula é útil para calcular a quantidade de nitrato de potássio necessária em uma reação, bem como para identificar os elementos e íons presentes no composto.
Massa molar de nitrato de potássio
KNO3 tem massa molar de 101,1 g/mol. Massa molar é a massa de um mol de uma substância e é calculada somando as massas atômicas de todos os átomos do composto. No caso do KNO3, a massa molar é calculada somando a massa atômica de um átomo de potássio, um átomo de nitrogênio e três átomos de oxigênio. Este valor é útil para determinar a quantidade de KNO3 necessária numa reação e para calcular outras propriedades, como a concentração.
Ponto de ebulição do nitrato de potássio
KNO3 tem um ponto de ebulição relativamente alto de 1,336 °C (2,437 °F). Isso significa que é necessária muita energia para quebrar as ligações entre os átomos do composto e convertê-lo de líquido em gás. Esta propriedade torna o KNO3 útil em aplicações que requerem reações a altas temperaturas, como na fabricação de fogos de artifício.
Ponto de fusão do nitrato de potássio
KNO3 tem um ponto de fusão de 334°C (633°F). Isto significa que em temperaturas acima de 334°C, o KNO3 mudará de sólido para líquido. Esta propriedade torna o KNO3 útil em aplicações como a fabricação de vidro, onde é usado como fundente para diminuir o ponto de fusão da sílica.
Densidade de nitrato de potássio g/mL
A densidade do KNO3 é 2,109 g/mL à temperatura ambiente. A densidade é uma medida da massa por unidade de volume de uma substância. A densidade do KNO3 é importante em aplicações como produção de fertilizantes, onde é utilizado como fonte de nitrogênio e potássio. A densidade também é útil para determinar a quantidade de KNO3 necessária em um determinado volume de solução.
Peso molecular do nitrato de potássio
O peso molecular do KNO3 é 101,1 g/mol. Este valor é calculado somando os pesos atômicos de todos os átomos do composto. O peso molecular é útil para calcular outras propriedades do KNO3, como a quantidade de KNO3 necessária em uma reação ou a concentração de uma solução.
Estrutura do nitrato de potássio
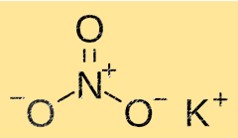
O KNO3 possui uma estrutura cristalina composta por íons potássio, nitrato e oxigênio. Os íons potássio estão rodeados por seis íons nitrato, enquanto os íons nitrato estão rodeados por seis íons potássio. Essa estrutura confere ao KNO3 suas propriedades características como solubilidade, ponto de fusão e densidade.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2,109 g/cm³ a 20°C |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 101,1032 g/mol |
| Densidade | 2,109g/cm³ |
| Ponto de fusão | 334°C (633°F) |
| Ponto de ebulição | 400°C (752°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 133 g/L a 20°C |
| Solubilidade | Solúvel em glicerol, amônia e água |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 4,75 |
| pH | 6,9 – 7,3 |
Segurança e perigos do nitrato de potássio
O KNO3 é relativamente seguro quando manuseado corretamente, mas pode apresentar perigos se manuseado incorretamente. É classificado como oxidante, o que significa que pode promover a combustão de outros materiais. O KNO3 também pode irritar os olhos, a pele e o trato respiratório e pode ser tóxico se ingerido ou inalado em grandes quantidades. É importante usar equipamentos de proteção como luvas, óculos de proteção e respirador ao manusear o KNO3, e armazená-lo em local fresco e seco, longe de materiais inflamáveis. Métodos de descarte adequados também devem ser seguidos para evitar a contaminação do meio ambiente.
| Símbolos de perigo | Ó, Xn |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Use luvas de proteção/proteção ocular/proteção facial. EM CASO DE INGESTÃO: Contacte um CENTRO DE INFORMAÇÃO ANTIVENENOS/médico se não se sentir bem. Enxágue a boca. NÃO induza o vômito. EM CASO DE INALAÇÃO: Remover a vítima para um local ao ar livre e mantê-la em repouso numa posição confortável para respirar. Ligue para um CENTRO DE INFORMAÇÃO ANTIVENENOS/médico. |
| Números de identificação da ONU | 1486 |
| Código SH | 2834.21.00 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | III |
| Toxicidade | Pode causar irritação respiratória, tosse e falta de ar se inalado. Pode causar irritação nos olhos e na pele. A ingestão pode causar dor abdominal, náusea, vômito e diarréia. Pode ser tóxico se ingerido ou inalado em grandes quantidades. |
Métodos de síntese de nitrato de potássio
Vários métodos podem sintetizar KNO3.
Um método comum é a reação entre hidróxido de potássio e ácido nítrico . O recipiente de reação mistura as duas substâncias e as aquece a uma temperatura elevada, geralmente em torno de 80°C. Depois disso, a mistura esfria e o processo de filtração recupera o KNO3 sólido.
Outro método é a reação entre cloreto de potássio e nitrato de sódio. Uma pessoa mistura as duas substâncias em um recipiente de reação e as aquece a uma temperatura elevada, geralmente em torno de 600°C.
A mistura resultante derrete e depois solidifica, formando cristais de KNO3.
Um terceiro método envolve a oxidação da amônia pelo ácido nítrico na presença de um catalisador. Este método é mais complexo e geralmente utilizado em escala industrial.
O KNO3 pode ser extraído de fontes naturais, como cavernas e depósitos subterrâneos. No entanto, este método é menos comum devido aos baixos rendimentos e às impurezas presentes no KNO3 extraído.
Usos do nitrato de potássio
O KNO3 tem uma ampla gama de utilizações em diversas indústrias devido às suas propriedades químicas. Aqui estão alguns usos comuns do KNO3:
- Fertilizante – Utilizado como fertilizante devido ao seu alto teor de nitrogênio e potássio. É particularmente útil para culturas que requerem elevados níveis de potássio, como frutas, vegetais e tabaco.
- Conservação de Alimentos – Também utilizado como conservante de alimentos, principalmente em carnes curadas. Inibe o crescimento de bactérias e evita a deterioração, prolongando assim a vida útil do produto.
- Pirotecnia – É elemento fundamental na fabricação de fogos de artifício e outros artefatos pirotécnicos. Atua como oxidante, produzindo oxigênio para alimentar a combustão de outros materiais.
- Pasta de dente – Adicionada a alguns cremes dentais para reduzir a sensibilidade dentária. Funciona bloqueando a transmissão de sinais de dor do nervo dentário para o cérebro.
- Usos Medicinais – Usado medicinalmente por suas propriedades diuréticas e expectorantes. Também trata angina e hipertensão.
- Aplicações Industriais – Também utilizado em diversas aplicações industriais, como produção de vidro, cerâmica e corantes.
Questões:
P: O nitrato de potássio é solúvel em água?
R: Sim, o KNO3 é altamente solúvel em água. À temperatura ambiente, 100 gramas de água podem dissolver aproximadamente 37 gramas de KNO3.
P: Para que é usado o nitrato de potássio?
R: O KNO3 é usado para diversos fins, inclusive como fertilizante, conservante de alimentos, oxidante pirotécnico, ingrediente de pasta de dente e como componente na produção de vidro, cerâmica e corantes.
P: O que é nitrato de potássio?
R: O nitrato de potássio, também conhecido como salitre, é um composto químico com a fórmula KNO3. É um sal iônico composto por íons potássio (K+) e íons nitrato (NO3-).
P: O que neutraliza o nitrato de potássio?
R: Os íons de cálcio e magnésio podem neutralizar os efeitos nocivos do excesso de KNO3 nas plantas. Em humanos, não existe antídoto conhecido para o envenenamento por KNO3 e o tratamento é muito útil.
P: O kno3 é solúvel em água?
R: Sim, o KNO3 é altamente solúvel em água.
P: O que é um produto da eletrólise da água contendo uma baixa concentração de kno3?
R: Os produtos da eletrólise da água contendo baixa concentração de KNO3 são o gás hidrogênio (H2) e o gás oxigênio (O2).
P: O que é kno3?
R: KNO3 é a fórmula química do nitrato de potássio, também conhecido como salitre.
P: Qual é o estado de oxidação de um átomo de nitrogênio individual em kno3?
R: No KNO3, o estado de oxidação de cada átomo de nitrogênio é +5.
P: O kno3 é um ácido ou uma base?
R: KNO3 não é um ácido nem uma base. É um sal composto por um cátion (K+) e um ânion (NO3-).
