O bromo (Br2) é uma molécula diatômica composta por dois átomos de bromo. É um líquido marrom avermelhado à temperatura ambiente e muito reativo. É usado em diversas indústrias, incluindo farmacêutica, agricultura e tratamento de água.
| Nome IUPAC | Bromo |
| Fórmula molecular | Br2 |
| Número CAS | 7726-95-6 |
| Sinônimos | Bromo, Bromo molecular, ONU 1744, Bromo diatômico, Bromo-79, Bromo-81 |
| InChI | InChI=1S/Br2/c1-2 |
Propriedades do bromo
Fórmula de bromo
A fórmula química do bromo é Br2. Isto significa que uma molécula de bromo contém dois átomos de bromo. A fórmula é usada para representar a composição de uma substância e é essencial nas reações químicas. A fórmula do bromo é usada em vários setores, incluindo farmacêutico, tratamento de água e agricultura.
Massa molar de bromo
A massa molar do Br2 é 159,808 g/mol. É a massa de um mol de moléculas de Br2. A massa molar é uma propriedade essencial na química porque ajuda a determinar a quantidade de substância necessária para uma determinada reação. Também é usado para converter gramas e moles de uma substância.
Ponto de ebulição do bromo
Br2 tem um ponto de ebulição de 58,8°C (137,8°F). Esta é a temperatura na qual o Br2 muda de líquido para gás. O baixo ponto de ebulição do Br2 se deve às suas fracas forças intermoleculares, que permitem que as moléculas escapem mais facilmente do estado líquido. A alta reatividade do Br2 torna-o uma substância perigosa para manuseio em altas temperaturas.
Ponto de fusão do bromo
O ponto de fusão do Br2 é -7,2°C (19,0°F). Esta é a temperatura na qual o Br2 sólido muda para o estado líquido. O baixo ponto de fusão do Br2 se deve às suas fracas forças intermoleculares, que permitem que as moléculas se movam mais facilmente no estado sólido. O Br2 tem a propriedade única de existir na forma líquida à temperatura ambiente, o que é raro entre os halogênios.
Densidade de bromo g/mL
A densidade do Br2 é 3,12 g/mL. Isso significa que um mililitro de Br2 tem massa de 3,12 gramas. A alta densidade do Br2 se deve ao seu peso molecular e à estanqueidade de suas moléculas no estado líquido. A alta densidade do Br2 o torna útil em reações pesadas de síntese orgânica.
Peso molecular do bromo
O peso molecular do Br2 é 79,90 g/mol. É a soma dos pesos atômicos dos dois átomos de Br na molécula de Br2. O peso molecular é uma propriedade essencial na química porque ajuda a determinar a quantidade de substância necessária para uma determinada reação.
Estrutura do bromo
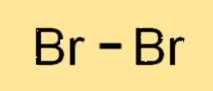
Br2 é uma molécula diatômica, o que significa que é feita de dois átomos de Br ligados entre si. Os dois átomos de Br2 compartilham um par de elétrons formando uma ligação covalente. A molécula de Br2 tem uma estrutura linear, com os dois átomos de Br dispostos em linha reta. A estrutura do Br2 é semelhante a outros halogênios, como cloro e iodo.
| Aparência | Líquido marrom avermelhado |
| Gravidade Específica | 3,12g/ml |
| Cor | marrom avermelhado |
| Cheiro | Odor pungente e irritante |
| Massa molar | 159.808 g/mol |
| Densidade | 3,12g/ml |
| Ponto de fusão | -7,2°C (19,0°F) |
| Ponto de ebulição | 58,8°C (137,8°F) |
| Ponto flash | Não inflamável |
| Solubilidade em Água | 3,41g/100ml (25°C) |
| Solubilidade | Solúvel em clorofórmio, tetracloreto de carbono e éter |
| Pressão de vapor | 1,13kPa a 25°C |
| Densidade do vapor | 5,4g/L |
| pKa | -5 |
| pH | Não aplicável |
Segurança e perigos do bromo
Br2 é um produto químico perigoso e deve ser manuseado com cuidado. É um líquido corrosivo que pode causar irritação grave na pele e nos olhos. A inalação de vapores de Br2 pode causar problemas respiratórios e a exposição a níveis elevados pode ser fatal. O Br2 também é um forte agente oxidante e pode reagir violentamente com materiais inflamáveis, causando incêndios ou explosões. Equipamentos de proteção adequados, como luvas, óculos de proteção e respiradores, devem sempre ser usados ao trabalhar com Br2. Deve ser armazenado em local fresco, seco e bem ventilado, longe de fontes de calor e materiais incompatíveis. Em caso de derramamento ou acidente, evacue a área imediatamente e siga os procedimentos de limpeza adequados.
| Símbolos de perigo | Caveira e Ossos Cruzados, Corrosivos |
| Descrição de segurança | Muito tóxico, corrosivo e irritante para a pele, olhos e vias respiratórias. |
| Números de identificação da ONU | ONU1744 |
| Código SH | 2801,30 |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato) = 2 a 3 mg/kg |
Métodos de síntese de bromo
Diferentes métodos podem ser utilizados para sintetizar Br2, dependendo da pureza e quantidade desejada.
Um método envolve o tratamento da salmoura com cloro gasoso na presença de um catalisador como o ferro. A solução resultante de hipoclorito de sódio e cloreto de sódio é então acidificada com ácido clorídrico, que libera gás Br2.
Outro método envolve a oxidação do gás brometo de hidrogênio com gás oxigênio na presença de um catalisador como platina ou amianto. As indústrias geralmente usam esse método para produzir Br2 de alta pureza para suas aplicações.
A eletrólise extrai o Br2 da salmoura passando uma corrente elétrica pela solução, que separa os íons sódio e cloreto e produz o gás Br2 como subproduto.
Usos do bromo
O Br2 tem vários usos importantes em diversas indústrias, incluindo:
- Os fabricantes utilizam compostos à base de Br como retardadores de chama em têxteis, plásticos e equipamentos eletrônicos para reduzir o risco de incêndio, evitando a propagação de chamas.
- As empresas farmacêuticas incorporam compostos à base de Br na produção de diversos sedativos, tranquilizantes e analgésicos.
- As estações de tratamento de água usam compostos à base de Br como desinfetante para matar eficazmente bactérias, vírus e outros organismos prejudiciais.
- Os produtores de pesticidas e herbicidas utilizam compostos à base de Br para controlar eficazmente pragas e ervas daninhas.
- A indústria de petróleo e gás utiliza compostos à base de Br em operações de perfuração para controlar a corrosão e melhorar a recuperação de petróleo.
- Os produtores utilizam compostos à base de Br na produção de filmes e papéis fotográficos para controlar eficazmente a sensibilidade e o contraste das imagens.
- As reações de síntese química usam Br2 como reagente para produzir corantes, plásticos e produtos farmacêuticos.
Questões:
P: O Br2 é polar ou apolar?
R: Br2 é uma molécula apolar porque ambos os átomos de bromo têm a mesma eletronegatividade, resultando em compartilhamento igual de elétrons na ligação covalente.
P: Qual composto provavelmente contém ligações covalentes polares? NaCl, AlF3, Br2, NF3?
R: O composto que provavelmente contém ligações covalentes polares é o NF3 (trifluoreto de nitrogênio), porque os átomos de nitrogênio e flúor têm eletronegatividades muito diferentes, resultando em compartilhamento desigual de elétrons na ligação covalente.
P: Qual é ΔH0 para esta reação? Br2 (g) → Br2 (l), ΔHf° Br2 (g) = 30,91 kJ/mol
R: O ΔH0 da reação é -10,57 kJ/mol, porque o calor de vaporização do Br2 é 41,48 kJ/mol e o calor de fusão é 30,91 kJ/mol (dado na pergunta).
P: O Br2 é um gás?
R: O Br2 pode existir nos estados gasoso e líquido dependendo das condições de temperatura e pressão. À temperatura ambiente e pressão padrão, o Br2 é um líquido marrom-avermelhado.
P: Para que é usado o bromo?
R: O bromo tem vários usos importantes em vários setores, incluindo retardadores de chama, tratamento de água, produtos farmacêuticos, pesticidas, indústria de petróleo e gás, fotografia e síntese química.
P: O bromo é um metal?
R: Não, o bromo não é um metal. É um elemento não metálico do grupo dos halogênios da tabela periódica.
