O peróxido de magnésio (MgO2) é um composto feito de magnésio e oxigênio. É comumente usado na agricultura como fonte de oxigênio de liberação lenta e como corretivo do solo para melhorar o crescimento das plantas.
| Nome IUPAC | Peróxido de magnésio |
| Fórmula molecular | MgO2 |
| Número CAS | 14452-57-4 |
| Sinônimos | Dióxido de magnésio, magnésio; peróxido, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| InChI | InChI=1S/Mg.2O2/h;2*1H/q+2;;/p-2 |
Propriedades do peróxido de magnésio
Fórmula de Peróxido de Magnésio
A fórmula química do peróxido de magnésio é MgO2. Isto significa que uma molécula de peróxido de magnésio contém um átomo de magnésio e dois átomos de oxigênio. A fórmula é importante porque identifica o tipo e o número de átomos presentes no composto e ajuda a determinar a estequiometria das reações químicas envolvendo o peróxido de magnésio.
Massa molar de peróxido de magnésio
O MgO2 tem massa molar de 56.304 g/mol. Isto significa que um mol de MgO2 contém 56.304 gramas do composto. A massa molar é uma propriedade importante do MgO2 porque ajuda a determinar quanto da substância é necessária para as reações químicas.
Ponto de ebulição do peróxido de magnésio
O MgO2 não tem um ponto de ebulição definido porque se decompõe antes de ferver. Quando aquecido, decompõe-se em óxido de magnésio e gás oxigênio. Esta propriedade do MgO2 o torna útil como fonte de oxigênio em diversas aplicações.
Ponto de fusão do peróxido de magnésio
O MgO2 tem um ponto de fusão de 223°C. Isto significa que em temperaturas acima de 700°C, o composto sólido se transforma em líquido. O ponto de fusão é uma propriedade importante do MgO2 porque determina como o composto se comporta quando exposto a altas temperaturas.
Densidade do peróxido de magnésio g/mL
A densidade do MgO2 é 2,41 g/mL. Isto significa que um mililitro de MgO2 pesa 2,41 gramas. A densidade é uma propriedade importante do MgO2 porque ajuda a determinar a massa de um determinado volume do composto.
Peso molecular do peróxido de magnésio
O peso molecular do MgO2 é 56,304 g/mol. Isso significa que uma molécula de MgO2 tem massa de 56.304 unidades de massa atômica. O peso molecular é uma propriedade importante do MgO2 porque ajuda a determinar quanto da substância é necessária para as reações químicas.
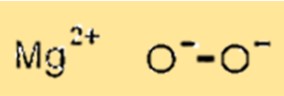
Estrutura do peróxido de magnésio
O MgO2 tem uma estrutura cristalina com íons de magnésio ocupando os locais octaédricos da estrutura reticulada e íons de oxigênio ocupando os locais tetraédricos. Esta estrutura cristalina é importante porque determina as propriedades físicas e químicas do MgO2.
| Propriedade | Valor |
| Aparência | pó branco |
| Gravidade Específica | 3,15g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 56,304 g/mol |
| Densidade | 2,41g/ml |
| Ponto de fusão | 223ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em ácidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do peróxido de magnésio
O MgO2 é geralmente considerado seguro quando manuseado e usado corretamente. No entanto, pode ser irritante para a pele, olhos e sistema respiratório. A ingestão de grandes quantidades pode causar irritação gastrointestinal, vômitos e diarreia. É importante evitar a inalação do pó e usar roupas e equipamentos de proteção ao manuseá-lo. O MgO2 não é inflamável nem explosivo, mas pode reagir com certos produtos químicos, como ácidos e oxidantes fortes. O armazenamento e o manuseio adequados são necessários para evitar reações acidentais. Se exposto ou ingerido, procure atendimento médico imediatamente.
| Símbolos de perigo | Ah, Xi |
| Descrição de segurança | O peróxido de magnésio pode causar irritação na pele e nos olhos, bem como irritação no trato respiratório se inalado. Pode ser prejudicial se ingerido ou em contacto com a pele e pode causar lesões oculares graves. Também existe risco de incêndio se exposto ao calor, chamas ou oxidantes. |
| Números de identificação da ONU | ONU1479 |
| Código SH | 282910 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | O peróxido de magnésio pode causar irritação na pele e nos olhos, bem como irritação no trato respiratório se inalado. Pode ser prejudicial se ingerido ou em contacto com a pele e pode causar lesões oculares graves. Também existe risco de incêndio se exposto ao calor, chamas ou oxidantes. |
Métodos de síntese de peróxido de magnésio
Existem vários métodos para sintetizar MgO2, cada um com suas vantagens e desvantagens.
Um método envolve a reação entre MgO e peróxido de hidrogênio . Neste método, você mistura MgO com uma pequena quantidade de água para formar uma pasta e, em seguida, adiciona peróxido de hidrogênio enquanto mexe a mistura. O produto resultante é MgO2 e água.
Outro método envolve a reação entre Mg(OH)2 e peróxido de hidrogênio . O químico dissolve Mg(OH)2 em água para formar uma solução, depois agita a mistura enquanto adiciona lentamente peróxido de hidrogênio . O produto resultante é MgO2 e água.
Um terceiro método envolve a reação direta entre o magnésio metálico e o gás oxigênio em altas temperaturas. Este método requer equipamento especializado e não é tão comumente usado como outros métodos.
Usos do peróxido de magnésio
O MgO2 tem vários usos em diversas indústrias, incluindo:
- Aplicações Ambientais – Usado como composto liberador de oxigênio na remediação de solos e águas subterrâneas para decompor poluentes.
- Agricultura – Usado como fertilizante e condicionador de solo devido às suas propriedades de liberação lenta de oxigênio que melhoram o crescimento das plantas.
- Médico – Utilizado em algumas formulações de cremes dentais como agente clareador e oxigenante para a saúde bucal.
- Fabricação Química – Utilizada na produção de especialidades químicas, como epóxis, perácidos e perésteres.
- Processamento de Alimentos – Usado como agente de branqueamento em farinhas e outros produtos alimentícios.
- Indústria Têxtil – Utilizado como agente branqueador na produção têxtil.
- Tratamento de Água – Usado para purificar a água liberando oxigênio e quebrando compostos orgânicos.
Questões:
P: Para que é usado o peróxido de magnésio?
R: O MgO2 é usado em diversas indústrias, como aplicações ambientais, agricultura, setor médico, fabricação de produtos químicos, processamento de alimentos, indústria têxtil e tratamento de água.
P: Quais são os produtos quando você mistura peróxido de hidrogênio e sulfato de magnésio?
R: Quando H2O2 e sulfato de magnésio são misturados, os produtos formados são MgO2, água e gás oxigênio.
P: O peróxido de magnésio é usado em laboratórios?
R: Sim, o MgO2 é utilizado em laboratórios para diversos fins como reações químicas, tratamento de água e saneamento ambiental.
P: O magnésio decompõe o peróxido de hidrogênio?
R: O magnésio não decompõe o H2O2 sozinho. No entanto, o magnésio pode reagir com H2O2 na presença de um catalisador, como o iodeto de potássio, para liberar gás oxigênio.
P: Qual das alternativas a seguir não é uma unidade de fórmula correta? k2o mgo2 al2o3 sro
R: Mgo2 não é uma unidade de fórmula correta. A unidade de fórmula correta para o óxido de magnésio é MgO.
P: Quais são os produtos desta reação combinada? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
R: O produto formado na reação combinada de mgo e co2 é mgco3.
P: Mgo2 líquido, gasoso ou sólido?
R: Mgo2 é um composto sólido.
