O sulfato de cálcio (CaSO4) é um pó branco que ocorre naturalmente ou é produzido industrialmente. É utilizado na construção, alimentação e medicina devido às suas propriedades como aglutinante, enchimento e nutriente.
| Nome IUPAC | Sulfato de Calcio |
| Fórmula molecular | CaSO4 |
| Número CAS | 7778-18-9 |
| Sinônimos | Gesso, gesso anidro, anidrita, di-hidrato, sal de cálcio, selenito |
| InChI | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriedades do sulfato de cálcio
Fórmula de sulfato de cálcio
A fórmula química do sulfato de cálcio é CaSO4. Isto significa que cada molécula de sulfato de cálcio contém um átomo de cálcio, um átomo de enxofre e quatro átomos de oxigênio. A fórmula é usada para representar a composição do sulfato de cálcio em equações químicas e para calcular a quantidade de reagentes necessários nas reações químicas.
Massa molar de sulfato de cálcio
A massa molar do CaSO4 é aproximadamente 136,14 g/mol. Este valor é calculado adicionando as massas atômicas de um átomo de cálcio, um átomo de enxofre e quatro átomos de oxigênio no composto. A massa molar é usada para determinar a quantidade de CaSO4 necessária nas reações químicas e para calcular sua concentração em soluções.
Ponto de ebulição do sulfato de cálcio
O CaSO4 não possui ponto de ebulição definido porque sofre decomposição térmica antes de atingir seu ponto de ebulição. No entanto, pode ser aquecido a temperaturas superiores a 200°C sem sofrer decomposição. Em temperaturas mais altas, o CaSO4 sofre decomposição endotérmica para formar óxido de cálcio e trióxido de enxofre.
Ponto de fusão do sulfato de cálcio
O ponto de fusão do CaSO4 depende do seu estado de hidratação. A forma anidra do CaSO4 tem um ponto de fusão de aproximadamente 1460°C, enquanto a forma di-hidratada tem um ponto de fusão inferior de aproximadamente 128°C. As formas hemi-hidratada e tri-hidratada possuem pontos de fusão intermediários.
Densidade de sulfato de cálcio g/mL
A densidade do CaSO4 depende da sua forma e do seu estado de hidratação. A forma anidra do CaSO4 tem densidade de aproximadamente 2,96 g/mL, enquanto a forma di-hidratada tem densidade de aproximadamente 2,32 g/mL. As formas hemihidratada e trihidratada possuem densidades intermediárias.
Peso Molecular do Sulfato de Cálcio
O peso molecular do CaSO4 é de aproximadamente 136,14 g/mol. Este valor é calculado adicionando as massas atômicas de um átomo de cálcio, um átomo de enxofre e quatro átomos de oxigênio no composto. O peso molecular é usado para calcular a quantidade de CaSO4 necessária nas reações químicas e para determinar sua concentração em soluções.
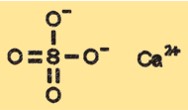
Estrutura do sulfato de cálcio
O CaSO4 possui uma estrutura cristalina que pode variar dependendo do seu estado de hidratação. A forma anidra do CaSO4 possui estrutura cristalina classificada como ortorrômbica, enquanto a forma dihidratada possui estrutura cristalina monoclínica. As formas hemi-hidratada e tri-hidratada possuem estruturas cristalinas diferentes que são intermediárias entre as formas anidra e di-hidratada.
| Aparência | Pó branco ou sólido |
| Gravidade Específica | 2,96 (anidro), 2,32 (di-hidrato) |
| Cor | Branco ou incolor |
| Cheiro | Inodoro |
| Massa molar | 136,14 g/mol |
| Densidade | 2,96 g/cm³ (anidro), 2,32 g/cm³ (di-hidratado) |
| Ponto de fusão | 1460°C (anidro), 128°C (di-hidratado) |
| Ponto de ebulição | Não tem ponto de ebulição definido |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 0,24g/100ml (20°C) |
| Solubilidade | Solúvel em água e glicerol, insolúvel em etanol |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 9,8 (primeira dissociação), 11,8 (segunda dissociação) |
| pH | 7 (neutro) |
Segurança e perigos do sulfato de cálcio
O CaSO4 é geralmente considerado seguro de usar e manusear, mas pode representar alguns riscos à saúde se não for manuseado adequadamente. A inalação de pó de CaSO4 pode causar irritação no sistema respiratório, enquanto a ingestão de grandes quantidades do composto pode causar distúrbios gastrointestinais. O contato dos olhos e da pele com CaSO4 pode causar irritação ou ressecamento. O CaSO4 também pode reagir com certos produtos químicos para produzir subprodutos perigosos. Portanto, deve-se usar equipamento de proteção individual adequado ao manusear CaSO4 e armazená-lo em área fresca, seca e bem ventilada, longe de materiais incompatíveis.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Perigoso se ingerido. Causa irritação na pele e nos olhos. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2833.29.00 |
| Classe de perigo | Não classificado como substância ou mistura perigosa de acordo com o Regulamento (CE) n.º 1272/2008 [CLP] |
| Grupo de embalagem | Não aplicável |
| Toxicidade | LD50 (oral, rato): > 2.000 mg/kg |
Métodos de síntese de sulfato de cálcio
Vários métodos permitem a síntese do CaSO4 dependendo da forma desejada e do estado de hidratação do composto.
Um método comum é reagir carbonato de cálcio ou óxido de cálcio com ácido sulfúrico. A reação produz CaSO4 e dióxido de carbono ou água, respectivamente.
Outro método envolve a reação do cloreto de cálcio com sulfato de sódio , resultando na precipitação de CaSO4. A desidratação térmica do gesso, uma forma mineral natural de CaSO4 di-hidratado, produz CaSO4.
Alguns processos industriais, como a dessulfurização de gases de combustão em usinas de energia, produzem CaSO4 como subproduto. Durante este processo, o dióxido de enxofre reage com o carbonato de cálcio para formar sulfito de cálcio, que sofre oxidação para produzir CaSO4.
O método de síntese utilizado para o CaSO4 pode afetar suas propriedades, como tamanho de partícula, cristalinidade e pureza. Portanto, é importante escolher o método apropriado à aplicação pretendida do composto.
Usos do sulfato de cálcio
O CaSO4 tem muitos usos em diferentes indústrias devido às suas propriedades únicas, incluindo baixa toxicidade, alto ponto de fusão e cor branca. Alguns usos comuns de CaSO4 incluem:
- Construção: Componente fundamental do cimento e do gesso cartonado, onde atua como aglutinante e massa.
- Alimentos e Bebidas: Utilizado como coagulante na produção de tofu e como agente firmador em alguns queijos e vegetais enlatados.
- Produtos farmacêuticos: Utilizados como enchimento e aglutinante na produção de comprimidos e cápsulas.
- Agricultura: Usado como corretivo do solo para melhorar a estrutura do solo e aumentar o rendimento das colheitas.
- Produtos Químicos: Utilizados na produção de diversos produtos químicos, como pigmentos, processamento de papel e têxteis.
- Cosméticos: Utilizado em formulações cosméticas como agente de volume e opacificação.
- Tratamento de Água: Utilizado no tratamento de água para remover impurezas e reduzir incrustações.
- Plásticos e Borracha: Usado como enchimento e agente de reforço em produtos de plástico e borracha.
Questões:
P: O sulfato de cálcio é vegano?
R: Sim, o CaSO4 é considerado vegano porque não vem de fontes animais.
P: Qual foi o principal uso do sulfato de cálcio em hospitais?
R: O CaSO4 era comumente usado em hospitais como gesso para fraturas ósseas.
P: Quais são as massas de sulfato de cálcio e fósforo?
R: Esta pergunta está incompleta e requer mais informações para fornecer uma resposta específica.
P: O CaSO4 é solúvel em água?
R: O CaSO4 possui baixa solubilidade em água, com solubilidade de aproximadamente 2,05 g/L à temperatura ambiente.
P: O CaSO4 é solúvel?
R: O sulfato de cálcio possui baixa solubilidade em água, com solubilidade de aproximadamente 2,05 g/L à temperatura ambiente.
P: Qual é a massa molar do CaSO4?
R: A massa molar do CaSO4 é aproximadamente 136,14 g/mol.
P: Qual sal tem pH <7? KBr, HCOOK, CaSO4, NH4NO3
R: Nenhum dos sais listados tem pH < 7 em sua forma pura. No entanto, quando dissolvido em água, o NH4NO3 (nitrato de amônio) produzirá uma solução ácida com pH <7.
