O bicarbonato de potássio (KHCO3) serve como um sal branco cristalino, amplamente utilizado como agente de saída na panificação, como agente extintor de incêndio e para neutralizar a acidez do solo na agricultura. Além disso, atua como suplemento nutricional e desempenha um papel em tratamentos médicos específicos.
| Nome IUPAC | Hidrogenocarbonato de potássio |
| Fórmula molecular | KHCO3 |
| Número CAS | 298-14-6 |
| Sinônimos | Hidrogenocarbonato de potássio, sal ácido de potássio, hidrogenocarbonato de potássio, PCN 0775, E501 |
| InChI | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Propriedades do bicarbonato de potássio
Fórmula de bicarbonato de potássio
A fórmula do bicarbonato de potássio é KHCO3. Esta fórmula indica que um íon potássio (K+) é combinado com um íon bicarbonato (HCO3-) para formar uma molécula de bicarbonato de potássio. A fórmula é importante em química porque fornece informações sobre os tipos e o número de átomos que constituem uma molécula.
Massa molar de bicarbonato de potássio
KHCO3 tem massa molar de 100,115 g/mol. Isto significa que um mol de KHCO3 contém 100,115 gramas do composto. A massa molar é uma propriedade importante de um composto porque é usada para calcular a quantidade de uma substância necessária para uma reação química. Além disso, a massa molar pode ser usada para converter gramas e moles de uma substância.
Ponto de ebulição do bicarbonato de potássio
O ponto de ebulição do KHCO3 não está bem definido, pois ele se decompõe antes de atingir o ponto de ebulição. Quando aquecido, o KHCO3 se decompõe em carbonato de potássio, dióxido de carbono e água. Portanto, a temperatura de decomposição do KHCO3 é utilizada para descrever sua estabilidade térmica.
Ponto de fusão do bicarbonato de potássio
KHCO3 tem um ponto de fusão de 292°C. A esta temperatura, o KHCO3 muda de sólido para líquido. O ponto de fusão de um composto é uma propriedade física importante porque determina as condições sob as quais o composto pode ser fundido e processado.
Densidade de bicarbonato de potássio g/mL
A densidade do KHCO3 é 2,17 g/mL. A densidade é uma medida da quantidade de massa por unidade de volume. A alta densidade do KHCO3 o torna um composto útil em aplicações como extintores de incêndio, onde é utilizado para extinguir incêndios de Classe B.
Peso Molecular do Bicarbonato de Potássio
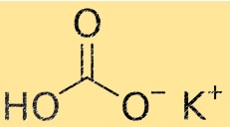
O peso molecular do KHCO3 é 100,115 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. Esta propriedade é importante em química porque é usada para calcular a quantidade de uma substância necessária para uma reação química.
Estrutura do bicarbonato de potássio
KHCO3 tem uma estrutura cristalina semelhante ao cloreto de sódio. O composto é composto por íons potássio (K+) e íons bicarbonato (HCO3-). Os íons potássio ocupam as posições dos íons sódio na estrutura cristalina do cloreto de sódio, enquanto os íons bicarbonato ocupam as posições dos íons cloreto.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2,17g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 100,115 g/mol |
| Densidade | 2,17g/cm³ |
| Ponto de fusão | 292ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 25g/100ml (20ºC) |
| Solubilidade | Solúvel em água |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 10,3 (ácido carbônico) |
| pH | 8,5 – 9,5 (solução a 1%) |
Segurança e perigos do bicarbonato de potássio
KHCO3 é geralmente considerado seguro quando usado conforme as instruções. No entanto, pode causar irritação na pele e nos olhos e deve ser manuseado com cuidado. Também pode ser prejudicial se ingerido em grandes quantidades. A inalação de poeira pode causar irritação do trato respiratório. Além disso, pode reagir com ácidos fortes para liberar dióxido de carbono, o que pode ser perigoso. Ao usar KHCO3, é importante seguir os procedimentos de segurança e usar equipamento de proteção adequado. Se ingerido, procure atendimento médico imediatamente. Em caso de contato com a pele ou olhos, lavar abundantemente a área afetada com água e procurar atendimento médico se a irritação persistir.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Nocivo se ingerido, causa irritação na pele e nos olhos. Evite a inalação. |
| Números de identificação da ONU | ONU 2987 |
| Código SH | 2836.30.00 |
| Classe de perigo | 8 (Corrosivo) |
| Grupo de embalagem | III |
| Toxicidade | LD50 (rato, oral): 6.400 mg/kg |
Métodos para a síntese de bicarbonato de potássio
Na presença de água, o dióxido de carbono reage com o carbonato de potássio para sintetizar KHCO3.
A reação ocorre da seguinte forma:
K2CO3 + CO2 + H2O → 2KHCO3
Outro método é reagir hidróxido de potássio com dióxido de carbono:
KOH + CO2 → KHCO3
O KHCO3 resultante pode então ser purificado por recristalização em água. O rendimento da reação depende da pureza das matérias-primas e das condições de reação.
Para produzir KHCO3, o cloreto de potássio pode reagir com bicarbonato de amônio e depois ser tratado com dióxido de carbono.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Este método tem a vantagem de utilizar matérias-primas baratas e não produzir subprodutos perigosos.
Usos do bicarbonato de potássio
KHCO3 tem uma ampla gama de utilizações em diversas indústrias e aplicações. Aqui estão alguns dos usos mais comuns:
- Indústria alimentícia: Utilizado como agente de saída em produtos de panificação, como bolos, biscoitos e pães, para ajudá-los a crescer.
- Agricultura: Usado como fungicida para controlar doenças fúngicas de plantas, como o oídio.
- Produtos farmacêuticos: Usados em antiácidos para neutralizar o ácido estomacal e tratar indigestão e azia.
- Extintores de Incêndio: Utilizados em extintores de incêndio como agente químico seco para extinguir incêndios de Classe B e Classe C.
- Aplicações laboratoriais: Usado em diversas aplicações laboratoriais, como tamponamento de pH e cultura celular.
- Produtos de higiene pessoal: Usados em cremes dentais como abrasivos suaves e em desodorantes para ajudar a controlar odores.
- Tratamento de Água: Utilizado no tratamento de água para ajustar o nível de pH e remover metais pesados e outras impurezas.
Questões:
P: O que é bicarbonato de potássio?
R: KHCO3 é um pó branco e inodoro comumente usado em diversas indústrias, como alimentícia, agrícola e farmacêutica. Possui fórmula química KHCO3 e é um sal composto por cátion potássio, ânion bicarbonato e moléculas de água.
P: O bicarbonato dos comprimidos efervescentes de potássio se transforma em dióxido de carbono?
R: Sim, quando os comprimidos efervescentes de potássio se dissolvem em água, o bicarbonato do comprimido reage com o ácido cítrico para liberar dióxido de carbono. Esta reação produz a efervescência e o borbulhar característicos associados aos comprimidos efervescentes.
P: O que acontece depois de adicionar bicarbonato de potássio ao vinho?
TEM: A adição de KHCO3 ao vinho reduz a acidez do vinho ao reagir com o excesso de ácido presente. Os enólogos costumam usar esse processo, denominado desacidificação, para melhorar o sabor e a qualidade do vinho.
P: Onde comprar bicarbonato de potássio?
R: O KHCO3 pode ser adquirido em vários fornecedores de produtos químicos, mercados online e lojas de suprimentos agrícolas. Também está comumente disponível em lojas e mercados de alimentos naturais.
P: Qual é o nome do composto com a fórmula KHCO3?
R: O composto com a fórmula KHCO3 é denominado bicarbonato de potássio.
P: O que foi feito no experimento para garantir que todo o KHCO3 reagiu?
R: Na experiência, para garantir que todo o KHCO3 reagiu, adicionou-se ácido em excesso à mistura reaccional e a reacção continuou até não ser produzido mais gás. A ausência de gás indicou que todo o KHCO3 reagiu com o ácido.
P: O que acontece se você aquecer KHCO3?
R: Quando o KHCO3 é aquecido, ele se decompõe para formar carbonato de potássio (K2CO3), água e dióxido de carbono. Esta reação ocorre da seguinte forma: 2KHCO3 → K2CO3 + H2O + CO2.
