O fosfato de potássio (K3PO4) é um composto que contém os elementos potássio e fósforo. É comumente utilizado como aditivo alimentar e fertilizante devido à sua alta solubilidade e capacidade de fornecer nutrientes essenciais para o crescimento das plantas.
| Nome da IUPAC | Fosfato de potássio |
| Fórmula molecular | K3PO4 |
| Número CAS | 7778-53-2 |
| Sinônimos | Fosfato tripotássico, ortofosfato de potássio, fosfato de potássio terciário, monofosfato tripotássico, fosfato tribásico de potássio |
| InChI | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Propriedades do fosfato de potássio
Fórmula de Fosfato de Potássio
A fórmula química do fosfato de potássio é K3PO4. Isto indica que o composto contém três íons K+ e um íon PO43- em cada unidade de fórmula. A fórmula do fosfato de potássio é útil para determinar a estequiometria das reações envolvendo o composto, bem como identificar a quantidade de cada elemento presente em uma determinada massa do composto.
Massa molar de fosfato de potássio
A massa molar do K3PO4 é 212,27 g/mol. É calculado adicionando as massas atômicas de potássio, fósforo e oxigênio ao composto. A massa molar é um parâmetro importante para determinar a quantidade de substância presente em uma determinada massa do composto. Também é útil para calcular a estequiometria de reações envolvendo K3PO4.
Ponto de ebulição do fosfato de potássio
O ponto de ebulição do K3PO4 é 1660°C. Este alto ponto de ebulição é devido às fortes ligações iônicas entre os íons K+ e os íons PO43- no composto. É também uma indicação da estabilidade do composto a altas temperaturas. O ponto de ebulição do K3PO4 é útil em diversas aplicações industriais, como na produção de cerâmica e vidro.
Ponto de fusão do fosfato de potássio
O ponto de fusão do K3PO4 é 1340°C. Esta é a temperatura na qual o composto sólido passa para o estado líquido. O alto ponto de fusão do K3PO4 se deve à natureza iônica do composto, que requer uma grande quantidade de energia para superar as forças de atração entre os íons. O ponto de fusão do K3PO4 é útil para determinar sua adequação para diversas aplicações, como a produção de fertilizantes e aditivos alimentares.
Densidade de fosfato de potássio g/mL
A densidade do K3PO4 é 2,564 g/mL à temperatura ambiente. A alta densidade do composto se deve à presença de três íons K+ e um íon PO43- em cada unidade da fórmula. A densidade do K3PO4 é útil na determinação de sua solubilidade e comportamento em diversos processos industriais, como na produção de fertilizantes e aditivos alimentares.
Peso Molecular do Fosfato de Potássio
O peso molecular do K3PO4 é 212,27 g/mol. É a soma dos pesos atômicos de todos os átomos do composto. O peso molecular é útil para calcular a quantidade de substância presente em uma determinada massa do composto, bem como para determinar a estequiometria das reações envolvendo K3PO4.
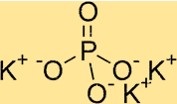
Estrutura do fosfato de potássio
K3PO4 possui uma estrutura cristalina ortorrômbica. Consiste em um conjunto de tetraedros PO4, com cada íon fosfato compartilhando dois átomos de oxigênio com íons fosfato vizinhos. Os íons de potássio estão localizados entre os tetraedros de fosfato, rodeados por átomos de oxigênio. A estrutura do K3PO4 é útil para a compreensão de suas propriedades, como solubilidade e estabilidade térmica.
| Aparência | Pó cristalino branco |
| Densidade específica | 2.564g/mL |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 212,27 g/mol |
| Densidade | 2.564g/mL |
| Ponto de fusão | 1340°C |
| Ponto de ebulição | 1660°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 100g/L (20°C) |
| Solubilidade | Solúvel em etanol e acetona, insolúvel em éter |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | pKa1 = 2,16, pKa2 = 7,21, pKa3 = 12,32 |
| pH | O pH de uma solução a 1% é 11,5 |
Segurança e perigos do fosfato de potássio
O K3PO4 é geralmente considerado seguro para uso quando manuseado corretamente. No entanto, como qualquer produto químico, pode representar perigo se for mal manuseado ou ingerido em grandes quantidades. O composto é classificado como irritante para a pele, olhos e vias respiratórias e pode causar queimaduras graves ou dificuldade respiratória se inalado ou ingerido em altas concentrações. Também é incompatível com ácidos e agentes oxidantes e pode causar incêndio ou explosão se exposto a estes materiais. Portanto, é importante manusear o K3PO4 com cautela, usar equipamento de proteção adequado e armazená-lo em local fresco, seco e bem ventilado, longe de substâncias incompatíveis.
| Símbolos de perigo | Xi (irritante) |
| Descrição de segurança | Evitar o contato com a pele e os olhos. |
| Números de identificação da ONU | ONU 2833 (para anidro), ONU 2423 (para trihidrato) |
| Código SH | 28352400 |
| Classe de perigo | 6.1 (tóxico) |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato): 2.340 mg/kg; LC50 (inalação, rato): 50 mg/L |
Métodos para a síntese de fosfato de potássio (K3PO4)
Existem vários métodos para sintetizar K3PO4, incluindo a reação do ácido fosfórico (H3PO4) com hidróxido de potássio (KOH) ou a decomposição térmica de KH2PO4.
Um método envolve a reação de quantidades equimolares de KOH e H3PO4 em água a uma temperatura de aproximadamente 60 a 80°C. O procedimento envolve evaporar a mistura resultante e aquecer o resíduo sólido a aproximadamente 300°C para produzir K3PO4.
Outro método é reagir KH2PO4 com KOH em alta temperatura (acima de 400°C) para produzir K3PO4 e água. Um forno especializado pode realizar esse processo denominado decomposição térmica.
A reação do ácido fosfórico com carbonato de potássio (K2CO3) e a reação do óxido de potássio (K2O) com pentóxido de fósforo (P2O5) são métodos adicionais para a produção de K3PO4.
Usos do fosfato de potássio
K3PO4 tem vários usos práticos em diversos setores, incluindo:
- Fertilizante: Comumente utilizado como fertilizante devido ao seu alto teor de fósforo. Os agricultores costumam adicioná-lo ao solo para fornecer nutrientes essenciais às plantas.
- Indústria Alimentar: Utilizado como aditivo alimentar para regular os níveis de acidez, prevenir a descoloração e melhorar a textura.
- Agente tampão: Várias aplicações laboratoriais o utilizam como um agente tampão eficaz, incluindo soluções tampão de calibração de pH e pesquisas biológicas.
- Detergentes: Utilizados na produção de detergentes e produtos de limpeza devido à sua capacidade de amaciar a água e prevenir o acúmulo de depósitos minerais.
- Remédio: Usado como suplemento dietético para tratar certas condições médicas, como níveis baixos de fosfato no sangue.
- Tratamento de Água: Utilizado no tratamento de água para evitar a formação de incrustações e corrosão em tubulações e equipamentos.
- Retardador de Chamas: Utilizado como retardador de chamas em diversos materiais, incluindo têxteis e plásticos, devido à sua capacidade de liberar vapor de água e evitar a propagação de chamas.
Questões:
P: O fosfato de potássio é solúvel em água?
R: Sim, o K3PO4 é solúvel em água.
P: Quantos íons potássio são necessários para se ligar a um íon fosfato?
R: Três íons potássio são necessários para se ligarem a um íon fosfato, formando K3PO4.
P: Que precipitado se forma quando soluções aquosas de brometo de cálcio e fosfato de potássio são misturadas?
R: Quando soluções aquosas de brometo de cálcio e K3PO4 são misturadas, forma-se um precipitado de fosfato de cálcio (Ca3(PO4)2).
P: O k3po4 é solúvel em água?
R: Sim, o K3PO4 é solúvel em água.
P: O k3po4 é solúvel?
R: Sim, o K3PO4 é solúvel em água.
P: Quais produtos resultam da mistura de soluções aquosas de Ni(C2H3O2)2 (aq) e K3PO4 (aq)?
R: Quando soluções aquosas de Ni(C2H3O2)2 e K3PO4 são misturadas, forma-se um precipitado de fosfato de níquel(II) (Ni3(PO4)2), assim como soluções aquosas de acetato de potássio (KCH3COO) e ácido acético (CH3COOH).
P: Qual elemento aumenta seu número de oxidação nesta reação? 3KOH + H3PO4 → K3PO4 + 3H2O
R: O elemento fósforo aumenta seu número de oxidação de +5 em H3PO4 para +5 em K3PO4.
P: O que é K3PO4?
R: K3PO4 é a fórmula química do fosfato de potássio, composto utilizado em diversas aplicações, como fertilizantes, aditivos alimentares e produtos de limpeza.
