O silicato de cálcio (Ca2SiO4) é um composto mineral utilizado em materiais de construção, isolamento e proteção contra fogo. É feito pela combinação de óxido de cálcio e sílica. O silicato de cálcio fornece isolamento térmico e é resistente ao fogo.
| Nome IUPAC | Silicato de cálcio |
| Fórmula molecular | Ca2SiO4 |
| Número CAS | 1344-95-2 |
| Sinônimos | Ácido silícico, sal de cálcio (2:1); Metasilicato de cálcio; Óxido de cálcio e silício; Ortossilicato de cálcio |
| InChI | InChI=1S/Ca.2O.Si/q+2;2*-1; |
Propriedades do silicato de cálcio
Massa molar de silicato de cálcio
Ca2SiO4 tem massa molar de 172.237 g/mol. Este valor é calculado somando as massas atômicas de cálcio, silício e oxigênio, que são 40,078 g/mol, 28,085 g/mol e 15,999 g/mol respectivamente. A massa molar é importante na determinação da quantidade de Ca2SiO4 necessária para reações químicas ou preparação de soluções.
Ponto de ebulição do silicato de cálcio
O Ca2SiO4 não tem ponto de ebulição definido porque se decompõe antes de atingir seu ponto de ebulição. Quando o Ca2SiO4 é aquecido, sofre uma série de reações químicas que levam à liberação de água e à formação de óxido de cálcio e sílica. A temperatura de decomposição do Ca2SiO4 depende do tipo específico e da composição do composto.
Ponto de fusão de silicato de cálcio
Ca2SiO4 tem um ponto de fusão de 2130°C. A esta temperatura, o Ca2SiO4 muda do estado sólido para o estado líquido. O ponto de fusão do Ca2SiO4 é relativamente alto, tornando-o adequado para aplicações em altas temperaturas, como materiais refratários, isolamento e proteção contra fogo.
Densidade de silicato de cálcio g/mL
A densidade do Ca2SiO4 varia dependendo do tipo específico e da composição do composto. A densidade do Ca2SiO4 varia de 2,2 a 2,8 g/mL. A alta densidade do Ca2SiO4 o torna útil para aplicações onde o peso é um problema. Por exemplo, é usado como agregado leve em concreto.
Peso molecular do silicato de cálcio
O peso molecular do Ca2SiO4 é 172,237 g/mol. Este valor é determinado adicionando os pesos atômicos de cálcio, silício e oxigênio ao composto. O peso molecular do Ca2SiO4 é utilizado em diversos cálculos, como na determinação da concentração de soluções ou na quantidade de composto necessária para reações químicas.
Estrutura do silicato de cálcio
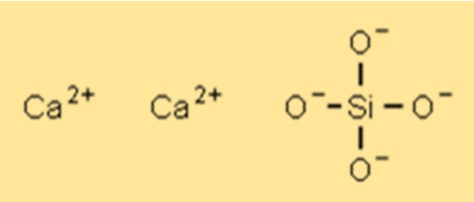
O Ca2SiO4 possui uma estrutura cristalina que pode variar dependendo do tipo específico e da composição do composto. A estrutura cristalina mais comum é um sistema cristalino monoclínico. A estrutura cristalina do Ca2SiO4 confere-lhe certas propriedades como alta resistência, estabilidade térmica e resistência química.
Fórmula de Silicato de Cálcio
A fórmula química do silicato de cálcio é Ca2SiO4. Esta fórmula representa a proporção de cálcio, silício e oxigênio no composto. A fórmula do silicato de cálcio é importante na determinação de suas propriedades e para sua utilização em diversas aplicações como cimento, isolamento e ignifugação.
| Aparência | pó branco |
| Gravidade Específica | 2,2 – 2,8 g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 172.237 g/mol |
| Densidade | 2,2 – 2,8 g/cm³ |
| Ponto de fusão | 2130°C |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Insolúvel em água, solúvel em ácidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | 7,0 – 9,0 |
Segurança e perigos do silicato de cálcio
O Ca2SiO4 é geralmente considerado seguro para uso em diversas aplicações, incluindo materiais de construção, isolamento e aditivos alimentares. Contudo, a inalação prolongada ou excessiva de poeira de Ca2SiO4 pode irritar o sistema respiratório. O contato da pele e dos olhos com Ca2SiO4 também pode irritar. Embora o Ca2SiO4 não seja considerado uma substância perigosa, é importante manuseá-lo com cuidado e seguir as precauções de segurança ao trabalhar com este material. Equipamentos de proteção individual, como luvas, óculos de segurança e proteção respiratória, devem ser usados ao manusear Ca2SiO4 para minimizar riscos potenciais à saúde.
| Símbolos de perigo | Não aplicável |
| Descrição de segurança | Não é uma substância perigosa |
| Números de identificação da ONU | Não aplicável |
| Código SH | 6810.19 |
| Classe de perigo | Não aplicável |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade; pode causar irritação respiratória e cutânea em caso de exposição prolongada ou excessiva |
Métodos de síntese de silicato de cálcio
Vários métodos podem sintetizar Ca2SiO4.
Num método, o óxido de cálcio (CaO) reage com a sílica (SiO2) para produzir uma mistura de silicatos de cálcio. O forno de alta temperatura permite a síntese de Ca2SiO4. A mistura inclui Ca2SiO4 e Ca3SiO5. O processamento e moagem adicionais da mistura produzem diferentes graus de pó de Ca2SiO4.
Outro método envolve a reação entre hidróxido de cálcio (Ca(OH)2) e sílica em autoclave a alta pressão e temperatura. Esse processo produz uma forma pura de Ca2SiO4, conhecida como wollastonita (CaSiO3), que possui uma ampla gama de aplicações, inclusive como carga em plásticos e revestimentos.
Outros métodos de síntese de Ca2SiO4 incluem a reação entre cloreto de cálcio (CaCl2) e silicato de sódio (Na2SiO3) para produzir hidrato de Ca2SiO4 (CSH), que é o principal ligante do cimento Portland.
Vários reagentes e métodos permitem a síntese de Ca2SiO4 precipitando-o a partir de uma solução de íons cálcio e silicato.
Usos do silicato de cálcio
O Ca2SiO4 possui uma ampla gama de aplicações devido às suas propriedades únicas, como resistência a altas temperaturas, baixa condutividade térmica e excelente resistência ao fogo. Aqui estão alguns usos comuns de Ca2SiO4:
- Isolamento: Usado como material isolante em aplicações de alta temperatura, como revestimentos de fornos, isolamento de caldeiras e linhas de vapor. Sua baixa condutividade térmica o torna um isolante eficaz nesses ambientes.
- Materiais de Construção: Utilizados em diversos materiais de construção, como tijolos, telhas e cimento. A sua resistência a altas temperaturas e ao fogo torna-o num material ideal para utilização em paredes e tectos resistentes ao fogo.
- Aditivos alimentares: Utilizados como agente antiaglomerante em produtos alimentícios, como açúcar de confeiteiro e sal. Sua capacidade de absorver umidade e evitar aglomerações o torna uma escolha popular entre os fabricantes de alimentos.
- Produtos farmacêuticos: Utilizado como excipiente em produtos farmacêuticos, onde atua como aglutinante, desintegrante e agente de fluxo.
- Cosméticos: Usado em cosméticos como agente inchador e absorvente. Ajuda a melhorar a textura e a sensação de produtos como pós faciais e bases.
- Outras utilizações: Também utilizado na produção de cerâmicas, materiais refratários e como carga em borrachas e plásticos.
Questões:
P: Como você remove o silicato de cálcio de uma piscina?
R: Para remover o Ca2SiO4 de uma piscina, use um limpador de azulejos de piscina ou uma solução de ácido muriático e água. Aplique o limpador ou solução na área afetada e esfregue com uma escova de cerdas duras. Enxágue com bastante água após a limpeza.
P: Como fazer silicato de cálcio refratário em casa?
R: Não é recomendado fazer Ca2SiO4 refratário em casa devido às altas temperaturas e equipamentos especializados necessários. É melhor comprar produtos refratários de Ca2SiO4 pré-fabricados de um fornecedor confiável.
P: Os compostos de silicato de cálcio hidratam-se para formar quais dois compostos?
A: Os compostos de Ca2SiO4 hidratam-se para formar Ca2SiO4 hidratado (CSH) e hidróxido de cálcio (Ca(OH)2). Esses compostos desempenham um papel importante na formação e resistência do concreto e de outros materiais cimentícios.
