O carbonato de potássio (K2CO3) é um pó branco e inodoro comumente usado na produção de sabão, vidro e cerâmica. Também pode ser usado como aditivo alimentar e agente tampão na indústria farmacêutica.
| Nome da IUPAC | Carbonato de potássio |
| Fórmula molecular | K2CO3 |
| Número CAS | 584-08-7 |
| Sinônimos | Ácido carbônico, sal dipotássico; Cinza pérola; Potassa; Sal de tártaro; Monocarbonato de potássio; Hidrogenocarbonato de potássio |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; eu |
Propriedades do carbonato de potássio
Fórmula de Carbonato de Potássio
A fórmula química do carbonato de potássio é K2CO3. Esta fórmula representa o número exato de átomos de cada elemento do composto. A fórmula pode ser usada para calcular a massa molar e outras propriedades do composto.
Massa molar de carbonato de potássio
K2CO3 tem massa molar de 138,21 g/mol. Isto significa que um mol de K2CO3 contém 138,21 gramas do composto. A massa molar é importante para determinar quanto de uma substância é necessária para uma reação ou experimento específico. Também é usado para converter a massa em moles de uma substância.
Ponto de ebulição do carbonato de potássio
K2CO3 tem um ponto de ebulição relativamente alto de 1.620 °C (2.948 °F). Isso o torna útil em aplicações de alta temperatura, como produção de vidro e cerâmica. O ponto de ebulição é a temperatura na qual uma substância passa de líquido para gás.
Ponto de fusão do carbonato de potássio
K2CO3 tem um ponto de fusão de 891°C (1.636°F). Este ponto de fusão relativamente alto é devido à natureza iônica do composto. Quando aquecida, as ligações iônicas entre os íons potássio e carbonato devem ser quebradas para que a substância derreta.
Densidade de Carbonato de Potássio g/mL
A densidade do K2CO3 é 2,43 g/mL à temperatura ambiente. Isso significa que um certo volume de K2CO3 possui uma certa massa. A densidade de uma substância é uma característica importante que pode ser usada para identificar a substância e calcular a massa ou volume de uma substância em um determinado espaço.
Peso Molecular do Carbonato de Potássio
O peso molecular do K2CO3 é 138,21 g/mol. Esta é a massa de um mol do composto, que é importante em muitos cálculos químicos.
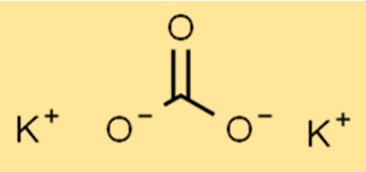
Estrutura do carbonato de potássio
K2CO3 possui estrutura iônica, com fórmula K2CO3. O íon potássio (K+) e o íon carbonato (CO32-) são mantidos juntos por ligações iônicas. O íon carbonato é um íon poliatômico composto por um átomo de carbono e três átomos de oxigênio.
| Aparência | Pó cristalino branco |
| Densidade específica | 2,43 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 138,21 g/mol |
| Densidade | 2,43g/ml |
| Ponto de fusão | 891°C (1.636°F) |
| Ponto de ebulição | 1620°C (2948°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 112 g/100 mL a 20°C |
| Solubilidade | Solúvel em água, glicerol e álcool |
| Pressão de vapor | Insignificante à temperatura ambiente |
| Densidade do vapor | Não aplicável |
| pKa | 10h33 |
| pH | 11,5 (solução aquosa a 10 g/L) |
Segurança e perigos do carbonato de potássio
O K2CO3 é geralmente considerado seguro para uso na indústria e em produtos domésticos. No entanto, pode ser irritante para a pele e os olhos e a inalação do pó pode causar irritação do trato respiratório. A exposição prolongada a altas concentrações de poeira K2CO3 pode causar danos aos pulmões. É importante usar equipamento de proteção individual adequado ao manusear este composto, incluindo luvas, óculos de proteção e máscara. O K2CO3 não é inflamável nem explosivo, mas pode reagir com ácidos para produzir dióxido de carbono, o que pode ser perigoso em espaços confinados. Em caso de ingestão ou contato com a pele ou olhos, procure atendimento médico imediatamente.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Use luvas, óculos de proteção e máscara. Evite contato prolongado com a pele e os olhos. Não inale o pó. |
| Números de identificação da ONU | ONU1863 |
| Código SH | 2836.40.00 |
| Classe de perigo | Não perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | O carbonato de potássio não é considerado tóxico, mas pode causar irritação respiratória e cutânea em altas concentrações. A exposição prolongada a altas concentrações de poeira pode causar danos aos pulmões. |
Métodos de síntese de carbonato de potássio
Vários métodos podem sintetizar K2CO3
Um método comum é reagir o hidróxido de potássio com o dióxido de carbono.
Para evitar a fuga de dióxido de carbono, esta reacção pode ser realizada num recipiente fechado.
Outro método envolve a reação de cloreto de potássio com carbonato de sódio em solução aquosa. O K2CO3 resultante precipita da solução e pode ser coletado por filtração.
Outra forma de sintetizar K2CO3 é reagir sulfato de potássio com carbono na presença de carvão. Historicamente, os químicos usaram o processo Leblanc para produzir K2CO3 em escala industrial. No entanto, as preocupações ambientais tornaram este processo raro hoje em dia, porque liberta dióxido de enxofre.
O K2CO3 pode ser sintetizado a partir do bicarbonato de potássio aquecendo-o a altas temperaturas, fazendo com que ele se decomponha em K2CO3 e dióxido de carbono. Um forno ou forno pode realizar esta reação.
Usos do carbonato de potássio
O K2CO3 possui uma ampla gama de aplicações em diversas indústrias devido às suas propriedades únicas. Alguns de seus usos comuns incluem:
- Produção de vidro: usado como fundente para diminuir o ponto de fusão da sílica e outros ingredientes.
- Indústria alimentícia: Utilizado como aditivo alimentar para regular a acidez e como agente de saída na panificação.
- Sabões e Detergentes: Também utilizado na fabricação de sabões e detergentes como amaciante de água.
- Indústria Farmacêutica: Utilizado como agente tamponante na formulação de medicamentos.
- Fertilizante: Também usado como fertilizante na agricultura para fornecer potássio às plantas.
- Produção cerâmica: Utilizado como fundente para reduzir a temperatura de queima e melhorar a qualidade do produto acabado.
- Fogos de artifício: Utilizados na produção de fogos de artifício para produzir uma chama roxa.
- Baterias: utilizadas na produção de baterias como eletrólito.
- Indústria têxtil: Utilizado como agente de tingimento.
Questões:
P: O carbonato de potássio é solúvel?
R: Sim, o carbonato de potássio é solúvel em água.
P: O K2CO3 é solúvel em água?
R: Sim, o K2CO3 é solúvel em água. Na verdade, é muito solúvel e pode dissolver-se em água para formar uma solução límpida e incolor.
P: Quantos gramas de carbonato de potássio são necessários para preparar 200 ml de uma solução 2,5 M?
R: Para preparar uma solução de 2,5 M de K2CO3 em 200 ml de água, você precisará dissolver 33,25 gramas de K2CO3 em água.
Cálculo: Molaridade = moles / volume (em litros) 2,5 M = moles / 0,2 L moles = 0,5 massa molar = moles x massa molar massa = 0,5 mole x 138,21 g/mol massa = 33,25g
P: Qual é a concentração de íons K em uma solução de K2CO3 0,045 M, assumindo dissociação completa?
R: Quando o K2CO3 está completamente dissociado em água, ele forma dois íons K+ e um íon CO3 2-. Portanto, a concentração de íons K+ em uma solução de K2CO3 0,045 M seria duas vezes a molaridade da solução de K2CO3, que é 0,090 M.
