O óxido de cálcio, também conhecido como cal viva, é uma substância branca e alcalina com alto ponto de fusão. Reage vigorosamente com a água para produzir hidróxido de cálcio e gera calor significativo. É usado em diversas aplicações industriais, incluindo fabricação de cimento, agricultura e tratamento de água.
| Nome IUPAC | Óxido de cálcio |
| Fórmula molecular | CaO |
| Número CAS | 1305-78-8 |
| Sinônimos | Cal viva; Cal queimada; Lima; Calx; Cal não apagada; Óxido de cálcio (II); Cálcia; Seixo de limão; Rocha calcária; Monóxido de cálcio; Limão fundente |
| InChI | InChI=1S/Ca.O |
Propriedades do óxido de cálcio
Fórmula de Óxido de Cálcio
A fórmula química do óxido de cálcio é CaO, o que indica que ele contém um cátion cálcio (Ca2+) e um ânion óxido (O2-). A fórmula do óxido de cálcio reflete sua natureza iônica, onde cátions de cálcio e ânions de óxido são mantidos juntos por fortes forças eletrostáticas. A fórmula do óxido de cálcio é usada para identificar o composto em diversas reações químicas e para calcular seu peso molecular e outras propriedades físicas.
Massa molar de óxido de cálcio
A massa molar do óxido de cálcio, também conhecido como cal viva, é de 56.077 gramas por mol. É derivado do peso atômico do cálcio (40,078 g/mol) e do oxigênio (15,999 g/mol) que compõem o composto. A massa molar do óxido de cálcio é usada em vários cálculos, como determinar a quantidade de reagente necessária para produzir uma quantidade específica de produto ou calcular a concentração de uma solução.
Ponto de ebulição do óxido de cálcio
O óxido de cálcio não tem ponto de ebulição porque sofre decomposição térmica em altas temperaturas em vez de ferver. Em temperaturas acima de 2.572°C, o óxido de cálcio dissocia-se em cálcio e oxigênio. No entanto, a decomposição térmica do óxido de cálcio pode ser utilizada para produzir óxido de cálcio com maior pureza e reatividade para aplicações industriais.
Ponto de fusão do óxido de cálcio
O ponto de fusão do óxido de cálcio é 2572°C, tornando-o uma substância com alto ponto de fusão. Possui um alto ponto de fusão devido à sua natureza iônica, onde cátions de cálcio e ânions de óxido são mantidos juntos por fortes forças eletrostáticas. O alto ponto de fusão do óxido de cálcio também o torna útil em aplicações de alta temperatura, como fabricação de aço e cimento.
Densidade de óxido de cálcio g/ml
A densidade do óxido de cálcio varia dependendo de sua estrutura cristalina e pureza. A densidade típica do óxido de cálcio é 3,35 g/mL para material a granel, enquanto a densidade teórica é 3,50 g/mL. A baixa densidade do óxido de cálcio se deve à sua estrutura porosa, que permite absorver a umidade do ar e aumentar seu peso e volume.
Peso molecular do óxido de cálcio
O peso molecular do óxido de cálcio, também chamado de peso de fórmula ou massa molar, é 56,077 gramas por mol. É calculado somando os pesos atômicos do cálcio e do oxigênio que compõem o composto. O peso molecular do óxido de cálcio é utilizado em vários cálculos, como na determinação da quantidade de reagente necessária para produzir uma quantidade específica de produto ou no cálculo da concentração de uma solução.
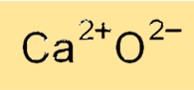
Estrutura do óxido de cálcio
O óxido de cálcio tem uma estrutura cristalina cúbica, onde os cátions de cálcio e os ânions de óxido estão dispostos em uma rede cúbica de face centrada. A estrutura cristalina do óxido de cálcio é semelhante à do cloreto de sódio e de outros compostos iônicos. A natureza iônica do óxido de cálcio o torna um bom isolante elétrico e um material importante na fabricação de componentes eletrônicos.
| Aparência | Sólido branco e inodoro |
| Gravidade Específica | 3,35g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 56,077 g/mol |
| Densidade | 3,35g/cm³ |
| Ponto de fusão | 2572°C |
| Ponto de ebulição | Não ferve, sofre decomposição térmica |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage com água formando hidróxido de cálcio |
| Solubilidade | Insolúvel em água, solúvel em ácido |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | 12-13 |
Segurança e perigos do óxido de cálcio
O óxido de cálcio, também conhecido como cal viva, é uma substância altamente reativa e cáustica que apresenta diversos riscos à saúde humana e ao meio ambiente. Pode causar irritação grave e queimaduras na pele, olhos e sistema respiratório se não for manuseado corretamente. A inalação de pó ou vapor de cal viva pode causar dificuldade respiratória, tosse e falta de ar. Também é muito reativo com água e pode liberar grandes quantidades de calor, resultando em queimaduras e explosões de vapor. a cal viva deve ser armazenada em local fresco, seco e bem ventilado, longe de substâncias incompatíveis. Equipamentos de proteção e procedimentos de manuseio adequados devem ser seguidos para evitar acidentes e exposição.
| Símbolos de perigo | Corrosivo (C) |
| Descrição de segurança | Use luvas, roupas e proteção para os olhos/face. Manuseie e guarde com cuidado. Evite inalação, ingestão e contato com a pele e os olhos. |
| Números de identificação da ONU | ONU1910 |
| Código SH | 2522.20.00 |
| Classe de perigo | 8 – Substâncias corrosivas |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos de síntese de óxido de cálcio
A decomposição térmica do calcário, a reação do hidróxido de cálcio com o calor e a eletrólise do cloreto de cálcio sintetizam óxido de cálcio ou cal viva.
O método mais comum para sintetizar cal virgem é aquecer a cal a uma temperatura elevada de cerca de 900 a 1000°C num forno de cal. Este processo, conhecido como calcinação, libera dióxido de carbono e deixa para trás cal virgem. O processamento e moagem de cal viva produz um pó fino para múltiplas aplicações.
Outro método de síntese de cal viva envolve o aquecimento do hidróxido de cálcio, também conhecido como cal apagada, a uma temperatura elevada. Esse processo, conhecido como desidroxilação, também libera água e deixa cal virgem.
A eletrólise do cloreto de cálcio é um método menos comum para sintetizar cal virgem. Dissolva o cloreto de cálcio em água e passe uma corrente elétrica pela solução para gerar cal virgem e gás cloro .
Usos do óxido de cálcio
O óxido de cálcio, também conhecido como cal virgem, tem muitos usos em diversas indústrias devido às suas propriedades únicas. Alguns de seus principais usos são:
- Produção de Aço: Utilizado como fundente na produção de aço, onde auxilia na remoção de impurezas e na melhoria da qualidade do aço.
- Tratamento de Água: Utilizado no tratamento de água para remover impurezas e ajustar o pH da água.
- Agricultura: Usado na agricultura como corretivo do solo para ajustar o pH do solo e fornecer nutrientes essenciais às plantas.
- Indústria química: utilizada na produção de produtos químicos como carboneto de cálcio, hipoclorito de cálcio e estearato de cálcio.
- Construção: Utilizado na indústria da construção como componente de cimento, argamassa e gesso.
- Indústria alimentícia: Utilizado na indústria alimentícia como agente firmador e regulador de acidez.
- Indústria de Papel: Utilizado na indústria de papel como componente do licor branco utilizado no processo de polpação kraft.
- Indústria Petrolífera: Utilizado na indústria petrolífera como catalisador no processo de refino.
Questões:
P: Qual é a fórmula do óxido de cálcio?
R: A fórmula do óxido de cálcio é CaO.
P: Qual é o número de oxidação do cálcio?
R: O número de oxidação do cálcio no óxido de cálcio é +2.
P: O óxido de cálcio é iônico ou covalente?
R: O óxido de cálcio é um composto iônico composto de íons de cálcio com carga positiva e íons de óxido com carga negativa.
P: O óxido de cálcio é um sólido?
R: Sim, o óxido de cálcio é um sólido à temperatura e pressão ambiente padrão. Tem uma aparência branca ou branco-acinzentada e é muito reativo.
