O benzeno ou C6H6 é um líquido incolor, altamente inflamável e com odor adocicado. É utilizado na produção de plásticos, fibras sintéticas, borracha, pesticidas e outros produtos químicos. É um conhecido agente cancerígeno e pode causar problemas de saúde.
| Nome da IUPAC | Benzeno |
| Fórmula molecular | C6H6 |
| Número CAS | 71-43-2 |
| Sinônimos | Benzol, Feno, Anuleno, Ciclohexatrieno, etc. |
| InChI | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Propriedades do benzeno
Massa molar do benzeno
O benzeno tem massa molar de 78,11 g/mol. É um composto orgânico cíclico composto por seis átomos de carbono e seis átomos de hidrogênio. A massa molar do benzeno é calculada somando as massas atômicas de seus átomos constituintes, que são 12,01 g/mol para carbono e 1,01 g/mol para hidrogênio. O benzeno é amplamente utilizado na indústria química como matéria-prima para a produção de muitos compostos importantes. A massa molar do benzeno é importante na determinação da quantidade de composto necessária para reações e outras aplicações.
Fórmula de benzeno
O benzeno tem a fórmula química C6H6. Esta fórmula representa o número e tipo de átomos presentes na molécula. A fórmula do benzeno é importante na determinação de suas propriedades físicas e químicas, bem como de sua reatividade em reações químicas. A fórmula do benzeno também é usada para nomear e identificar o composto em vários contextos, como na literatura química e em documentos regulatórios.
Ponto de ebulição do benzeno
O benzeno tem um ponto de ebulição de 80,1°C ou 176,2°F. Isto é relativamente baixo em comparação com outros compostos orgânicos de peso molecular semelhante. O ponto de ebulição do C6H6 é devido às suas forças de atração intermoleculares, notadamente as forças de Van der Waals. À medida que a temperatura aumenta, a energia cinética das moléculas também aumenta, levando em última análise à quebra destas forças intermoleculares e à transição da fase líquida para a fase gasosa. O baixo ponto de ebulição do C6H6 o torna útil em aplicações onde é necessário remover o composto por evaporação.
Ponto de fusão do benzeno
C6H6 tem um ponto de fusão de 5,5°C ou 41,9°F. Isto é relativamente baixo em comparação com outros compostos aromáticos de peso molecular semelhante. O ponto de fusão do C6H6 se deve à sua estrutura molecular, que consiste em um anel planar de átomos de carbono com ligações duplas alternadas. A disposição dos elétrons no anel confere ao C6H6 sua estabilidade característica e o torna resistente a muitas reações químicas. O baixo ponto de fusão do C6H6 o torna útil em aplicações onde é necessário fundir o composto para processamento posterior.
Densidade de benzeno g/ml
O benzeno tem uma densidade de 0,879 g/mL à temperatura ambiente (25°C ou 77°F). A densidade do benzeno é uma medida da massa por unidade de volume do composto. A baixa densidade do benzeno torna-o útil em aplicações onde é necessário um solvente de baixa densidade, como na separação de compostos com base na sua densidade.
Peso molecular do benzeno
O benzeno tem um peso molecular de 78,11 g/mol. O peso molecular do benzeno é a soma dos pesos atômicos de seus átomos constituintes. O peso molecular do benzeno é importante na determinação da estequiometria das reações e na determinação da concentração de benzeno em soluções.
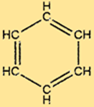
Estrutura do benzeno
C6H6 tem uma estrutura única que consiste em um anel hexagonal de átomos de carbono, cada um ligado a outros dois átomos de carbono e um átomo de hidrogênio. Ligações duplas alternadas no anel conferem ao C6H6 sua estabilidade característica e o tornam resistente a muitas reações químicas. A estrutura do C6H6 também o torna uma matéria-prima útil para a produção de muitos compostos importantes.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,879g/ml |
| Cor | Incolor |
| Cheiro | Macio |
| Massa molar | 78,11 g/mol |
| Densidade | 0,879g/ml |
| Ponto de fusão | 5,5°C (41,9°F) |
| Ponto de ebulição | 80,1°C (176,2°F) |
| Ponto flash | -11°C (12,2°F) |
| Solubilidade em Água | 1,79g/L |
| Solubilidade | Insolúvel em água, solúvel em solventes orgânicos |
| Pressão de vapor | 12,1kPa a 20°C |
| Densidade do vapor | 2,8 (ar=1) |
| pKa | 43,2 |
| pH | Neutro |
Segurança e perigos do benzeno
C6H6 é um composto altamente inflamável e tóxico que apresenta riscos significativos à saúde humana e ao meio ambiente. É um conhecido agente cancerígeno e pode causar leucemia, anemia aplástica e outras doenças do sangue em humanos. A exposição ao C6H6 pode ocorrer por inalação, contato com a pele ou ingestão e pode resultar em efeitos agudos e crônicos à saúde. É importante manusear o C6H6 com precauções de segurança adequadas, incluindo ventilação adequada, roupas de proteção e proteção respiratória. O C6H6 também deve ser armazenado e eliminado de acordo com os regulamentos locais para minimizar a contaminação ambiental e os riscos para a saúde pública.
| Símbolos de perigo | Caveira e Ossos Cruzados, Chama |
| Descrição de segurança | Altamente inflamável, Tóxico, Carcinogênico, Nocivo por ingestão, Irritante |
| Identificadores AN | ONU 1114 (Benzeno), ONU 1992 (Líquidos inflamáveis e tóxicos) |
| Código SH | 2902.20.00 |
| Classe de perigo | 3 (Líquidos inflamáveis), 6.1 (Substâncias tóxicas), 8 (Substâncias corrosivas) |
| Grupo de embalagem | II (Benzeno), III (Líquidos inflamáveis e tóxicos) |
| Toxicidade | Toxicidade aguda: Muito tóxico (LD50: 2,5 g/kg por via oral, 0,44 mg/L por inalação), Toxicidade crônica: Carcinogênico, Mutagênico, Toxicidade reprodutiva |
Métodos de síntese de benzeno
Existem vários métodos para sintetizar benzeno, um importante produto químico industrial utilizado na produção de plásticos, borracha e produtos farmacêuticos.
Um método comum é a reforma catalítica da nafta de petróleo, que envolve o aquecimento da nafta a altas temperaturas na presença de um catalisador, como platina ou rênio, para produzir uma mistura de hidrocarbonetos aromáticos, incluindo benzeno.
Outro método é a hidrodesalquilação do tolueno, que envolve a reação do tolueno com hidrogênio na presença de um catalisador, como óxido de cromo ou óxido de molibdênio, para remover o grupo metil e formar benzeno.
A pirólise de hidrocarbonetos, como carvão ou petróleo, em altas temperaturas na ausência de oxigênio sintetiza benzeno. Este processo resulta na formação de uma mistura de hidrocarbonetos aromáticos, incluindo o benzeno.
Outros métodos de síntese de benzeno incluem a reação do acetileno consigo mesmo na presença de um catalisador, como o cobre, para formar benzeno, bem como a reação do fenol com formaldeído na presença de um catalisador ácido, como o ácido sulfúrico, para formar benzeno. produzir benzeno.
Cada um destes métodos tem as suas próprias vantagens e desvantagens, dependendo de fatores como custo, eficácia e impacto ambiental. A escolha do método de síntese de benzeno dependerá da aplicação específica e dos requisitos do processo de produção.
Usos do benzeno
O benzeno é um produto químico industrial versátil e importante, com uma ampla gama de aplicações em diversas indústrias. Alguns dos principais usos do benzeno são:
- Produção de plásticos: utilizado na produção de diversos tipos de plásticos, incluindo poliestireno, poliuretano e náilon.
- Produção de borracha: Os produtores de borracha sintética utilizam-na em sua produção. Os fabricantes então usam essa borracha sintética para criar pneus, tubos, correias e outros produtos de borracha.
- Produção farmacêutica: Utilizada como matéria-prima para a produção de diversos produtos farmacêuticos, incluindo antibióticos, anti-histamínicos e analgésicos.
- Solvente: Usado como solvente para uma ampla gama de compostos orgânicos, incluindo gorduras, óleos, resinas e ceras.
- Combustível: Utilizado como aditivo de combustível de alta octanagem, melhorando o desempenho dos motores a gasolina.
- Extração de Óleo: Utilizado na extração de óleos, como óleos vegetais e óleos essenciais, de plantas.
- Adesivos: Utilizados na produção de adesivos, como cimento de borracha e cimento de contato.
- Corantes: Utilizados na produção de diversos tipos de corantes, inclusive corantes sintéticos utilizados na indústria têxtil.
Questões:
P: O benzeno é polar?
R: Não, o benzeno é uma molécula apolar porque tem uma estrutura simétrica e as polaridades das ligações individuais se cancelam.
P: Para que é usado o benzeno?
R: O benzeno é usado na produção de diversos materiais, incluindo plásticos, borracha, produtos farmacêuticos, solventes, aditivos de combustível, adesivos e corantes.
P: Qual composto conduzirá eletricidade quando dissolvido em água? CH4, CuSO4, C6H6 ou C6H12O6?
R: O CuSO4 conduz eletricidade quando dissolvido em água porque se dissocia em íons, permitindo o fluxo da corrente elétrica.
P: O C6H6 é polar ou apolar?
R: C6H6, também conhecido como benzeno, é uma molécula apolar porque tem uma estrutura simétrica e as polaridades das ligações individuais se cancelam.
P: O C6H6 é solúvel em água?
R: Não, o C6H6 não é solúvel em água porque é uma molécula apolar e não interage bem com solventes polares como a água.
