O ácido fosfórico (H3PO4) é um ácido mineral incolor e inodoro. É amplamente utilizado na indústria de alimentos e bebidas como agente aromatizante e como inibidor de ferrugem na indústria automobilística.
| Nome IUPAC | Ácido fosfórico |
| Fórmula molecular | H3PO4 |
| Número CAS | 7664-38-2 |
| Sinônimos | Ácido ortofosfórico, tri-hidroxidooxidofósforo, ácido fosfórico (V), ácido ortofosfórico, tecnologia de ácido fosfórico claro, fosfosaeur |
| InChI | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
Propriedades do ácido fosfórico
Massa molar de ácido fosfórico
A massa molar do ácido fosfórico é 98,00 g/mol. Este valor é calculado somando as massas atômicas de cada um dos átomos constituintes da molécula, que são um átomo de fósforo e três átomos de oxigênio. A massa molar é uma propriedade importante de um composto porque é usada para calcular a quantidade de substância presente em uma determinada amostra usando o número de Avogadro. Além disso, a massa molar do ácido fosfórico é usada para determinar a concentração de uma solução por titulação.
Fórmula de Ácido Fosfórico
A fórmula química do ácido fosfórico é H3PO4, o que indica que contém um átomo de fósforo, três átomos de hidrogênio e quatro átomos de oxigênio. É um ácido fraco que pode doar até três íons de hidrogênio para uma base. A fórmula é importante porque permite escrever equações químicas e calcular a estequiometria das reações químicas envolvendo ácido fosfórico. Além disso, a fórmula é usada para calcular a concentração de uma solução de ácido fosfórico por titulação.
Ponto de ebulição do ácido fosfórico
O ponto de ebulição do ácido fosfórico é 158°C (316°F) à pressão de 1 atmosfera. Isto significa que a esta temperatura e pressão, a fase líquida do ácido fosfórico se transformará em fase gasosa. O ponto de ebulição depende das forças intermoleculares presentes no composto e, no caso do ácido fosfórico, é devido à presença de ligações de hidrogênio entre as moléculas. O ponto de ebulição é uma propriedade física importante de um composto porque é usado para determinar sua volatilidade, o que é útil em muitos processos industriais.
Ponto de fusão do ácido fosfórico
O ponto de fusão do ácido fosfórico é 42,35°C (108,23°F). Esta é a temperatura na qual a fase sólida do ácido fosfórico se transformará na fase líquida. O ponto de fusão depende da intensidade das forças intermoleculares presentes no composto e, no caso do ácido fosfórico, é devido à presença de ligações de hidrogênio entre as moléculas. O ponto de fusão é uma propriedade física importante de um composto porque é usado para determinar sua pureza e estabelecer sua identidade.
Densidade do ácido fosfórico g/ml
A densidade do ácido fosfórico é 1,685 g/ml à temperatura ambiente (25°C ou 77°F). Esta é a massa da substância por unidade de volume. A densidade é uma propriedade física de uma substância e é usada para calcular o volume de uma determinada massa da substância ou a massa de um determinado volume da substância. A densidade do ácido fosfórico é importante em muitos processos industriais, incluindo a produção de fertilizantes, detergentes e aditivos alimentares.
Peso molecular do ácido fosfórico
O peso molecular do ácido fosfórico é 98,00 g/mol. É a soma dos pesos atômicos de todos os átomos da molécula. O peso molecular é uma propriedade importante de um composto porque é usado para calcular a quantidade de substância presente em uma determinada amostra. Além disso, o peso molecular do ácido fosfórico é usado para determinar a concentração de uma solução por titulação.
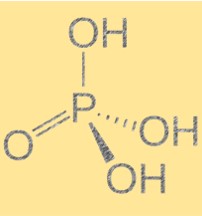
Estrutura do ácido fosfórico (H3PO4)
O ácido fosfórico tem uma fórmula molecular de H3PO4 e uma geometria molecular tetraédrica. É um ácido triprótico, o que significa que pode doar três íons de hidrogênio para uma base. A molécula contém um átomo de fósforo ligado a quatro átomos de oxigênio, três dos quais estão ligados a átomos de hidrogênio. A estrutura do ácido fosfórico é importante porque determina suas propriedades químicas e físicas. A presença de ligações de hidrogênio entre as moléculas dá origem a altos pontos de ebulição e fusão.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,685 a 25°C |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 98,00 g/mol |
| Densidade | 1,685 g/ml a 25°C |
| Ponto de fusão | 42,35°C (108,23°F) |
| Ponto de ebulição | 158°C (316°F) a 1 atm de pressão |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Completamente solúvel em água |
| Solubilidade | Solúvel em etanol, éter dietílico e acetona |
| Pressão de vapor | 0,0002 mmHg a 20°C |
| Densidade do vapor | 3,5 (ar = 1) |
| pKa | pKa1=2,148, pKa2=7,198, pKa3=12,319 |
| pH | 1,0 – 2,5 (solução concentrada), 2,8 – 3,2 (solução diluída) |
H3PO4 Segurança e perigos
O ácido fosfórico apresenta vários riscos de segurança e deve ser manuseado com cuidado. Pode causar irritação grave na pele e nos olhos e é muito corrosivo para os metais. O contato direto com a pele, olhos ou mucosas pode causar queimaduras graves ou até danos permanentes. A inalação de vapores pode causar irritação e queimaduras no trato respiratório. Não deve ser ingerido, pois pode causar queimaduras internas graves e distúrbios gastrointestinais. Ao manusear ácido fosfórico, deve-se usar equipamento de proteção individual adequado, como luvas, óculos de proteção e respirador. Também deve ser armazenado em local fresco e seco, longe de materiais incompatíveis, como agentes oxidantes e álcalis.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Mantenha o recipiente bem fechado. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. |
| Números de identificação da ONU | ONU1805 |
| Código SH | 280920 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II (perigo médio) |
| Toxicidade | LD50 oral (rato) – 1533 mg/kg |
Métodos de síntese de H3PO4
Existem vários métodos para sintetizar ácido fosfórico (H3PO4).
O método mais comum é o processo úmido que envolve a reação do fosfato natural com ácido sulfúrico . Para produzir sulfato de cálcio (gesso) e H3PO4, a rocha fosfática é primeiro triturada e depois misturada com ácido sulfúrico concentrado. Após filtrar a suspensão resultante, a série de etapas de extração com solvente e precipitação purifica o H3PO4.
Outro método de síntese de H3PO4 é o processo térmico que envolve o aquecimento da rocha fosfática a uma alta temperatura para produzir H3PO4 e outros subprodutos, como fósforo elementar e óxido de cálcio. Este método é menos comum que o processo úmido devido aos seus altos requisitos de energia.
A reação do pentóxido de fósforo com água sintetiza H3PO4. As indústrias eletrônicas e de semicondutores geralmente usam esse método para produzir H3PO4 de alta pureza.
Outros métodos de síntese de H3PO4 incluem oxidação eletroquímica de fósforo, hidrólise de tricloreto de fósforo e reação de fósforo com ácido nítrico . Esses métodos são menos comuns que os processos úmidos e térmicos devido ao seu alto custo e complexidade.
Usos do H3PO4
O ácido fosfórico é um composto versátil que possui uma ampla gama de aplicações em diversos setores. Alguns de seus principais usos são:
- Produção de fertilizantes: principal componente da produção de fertilizantes, como fosfato diamônico e superfosfato triplo.
- Indústria de alimentos e bebidas: utilizado como aditivo alimentar e agente aromatizante em diversos produtos alimentícios e bebidas, como refrigerantes de cola, geléias e queijos processados.
- Limpeza Industrial: Utilizado como limpador e removedor de ferrugem no setor industrial devido à sua capacidade de dissolver ferrugem e outros depósitos minerais.
- Tratamento de Água: Utilizado para controlar os níveis de pH da água em processos industriais e também para remover metais pesados e outras impurezas.
- Produtos farmacêuticos: Utilizados na produção de produtos farmacêuticos e suplementos dietéticos devido à sua capacidade de regular os níveis de pH.
- Odontologia: Utilizado em procedimentos odontológicos, como tratamento de canal radicular e como componente de cimento dentário.
- Tratamento de Metais: Usado para tratar e passivar metais como aço inoxidável, alumínio e titânio para melhorar sua resistência à corrosão.
- Eletrônicos: Utilizado na indústria eletrônica como agente de limpeza e como componente na produção de semicondutores.
Questões:
P: Qual é a fórmula do ácido fosfórico?
R: A fórmula do ácido fosfórico é H3PO4.
P: O H3PO4 é um ácido forte?
R: Não, o H3PO4 não é considerado um ácido forte. É um ácido fraco com valor de pKa de 2,15.
P: O H3PO4 é um ácido ou uma base?
R: H3PO4 é um ácido porque doa um próton (H+) quando dissolvido em água.
P: Qual é a estrutura de Lewis para H3PO4?
R: A estrutura de Lewis para H3PO4 é uma estrutura tetraédrica com um átomo central de fósforo rodeado por quatro átomos de oxigênio. Cada átomo de oxigênio forma uma ligação única com o átomo de fósforo, e também há três pares de elétrons solitários em cada átomo de oxigênio.
P: O ácido fosfórico é um ácido forte? R: Não, o ácido fosfórico não é considerado um ácido forte. É um ácido fraco com valor de pKa de 2,15 para a primeira doação de prótons e 7,20 para a segunda doação de prótons.
