O nitrato de cálcio é um composto químico com a fórmula Ca(NO3)2. É um sólido incolor e inodoro, muito solúvel em água. O nitrato de cálcio é comumente usado como fertilizante e no tratamento de águas residuais. Também é utilizado na produção de concreto, como componente de explosivos e na fabricação de diversos outros produtos químicos.
| Nome IUPAC | Dinitrato de cálcio |
| Fórmula molecular | Ca(NO3)2 |
| Número CAS | 10124-37-5 |
| Sinônimos | Nitrato de cálcio tetrahidratado, sal de cálcio de ácido nítrico, nitrocalcita, salitre norueguês, salitre de cal, norgessalpeter |
| InChI | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Fórmula de nitrato de cálcio
A fórmula do nitrato de cálcio é Ca(NO3)2. Isso significa que cada unidade de nitrato de cálcio contém um íon cálcio (Ca²⁺) e dois íons nitrato (NO3⁻). A fórmula do nitrato de cálcio é frequentemente usada para determinar a massa molar e outras propriedades do composto.
Massa molar de nitrato de cálcio
O nitrato de cálcio tem massa molar de 164.088 g/mol. É um sal composto por íons Ca+2 e NO3-, com fórmula Ca(NO3)2. A massa molar de um composto é a massa em gramas de um mol desse composto de fórmula, que é igual ao seu peso. No caso do Ca(NO3)2, o peso da fórmula é a soma dos pesos atômicos de todos os átomos do composto.
Ponto de ebulição do nitrato de cálcio
Ca(NO3)2 tem um ponto de ebulição relativamente alto de 132 graus Celsius. Isso significa que é necessária uma quantidade significativa de energia para converter o composto sólido em gás. O alto ponto de ebulição do Ca(NO3)2 é devido à sua natureza iônica, que resulta em fortes interações eletrostáticas entre os íons Ca+2 e NO3-.
Ponto de fusão do nitrato de cálcio
O ponto de fusão do Ca(NO3)2 é 561 graus Celsius. Isto é relativamente alto para um sal e mais uma vez reflete as fortes interações iônicas entre os íons Ca+2 e NO3-. O ponto de fusão do Ca(NO3)2 o torna um composto útil para aplicações em altas temperaturas, como na fabricação de fertilizantes ou explosivos.
Densidade de nitrato de cálcio g/ml
A densidade do Ca(NO3)2 varia dependendo da sua forma. Por exemplo, a densidade do Ca(NO3)2 anidro é de aproximadamente 2,5 g/cm³, enquanto a densidade do tetrahidrato (Ca(NO3)2.4H2O) é de aproximadamente 1,82 g/cm³. Esses valores tornam o Ca(NO3)2 um composto relativamente denso em comparação com muitos outros sais.
Peso molecular do nitrato de cálcio
O peso molecular do Ca(NO3)2 é 164,088 g/mol. Este valor é a soma dos pesos atômicos de todos os átomos do composto, que inclui dois átomos de nitrogênio, seis átomos de oxigênio e um átomo de cálcio.
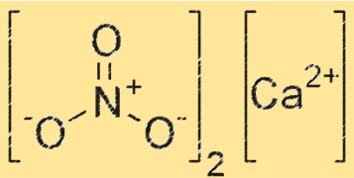
Estrutura do nitrato de cálcio
O Ca(NO3)2 possui estrutura iônica, com o íon cálcio (Ca²⁺) rodeado por seis átomos de oxigênio em um arranjo octaédrico. O íon NO3- também está presente na rede cristalina, com cada átomo de oxigênio do íon NO3- formando uma ligação de coordenação com o íon Ca+2. A estrutura do Ca(NO3)2 é semelhante à de outros compostos iônicos, como o cloreto de sódio.
| Aparência | Cristais brancos ou pó |
| Gravidade Específica | 2,5 (anidro); 1,82 (tetrahidrato) |
| Cor | Incolor (anidro); Branco (tetrahidrato) |
| Cheiro | Inodoro |
| Massa molar | 164.088 g/mol |
| Densidade | 2,5 g/cm³ (anidro); 1,82 g/cm³ (tetrahidrato) |
| Ponto de fusão | 561°C (anidro); 45°C (tetrahidrato) |
| Ponto de ebulição | 132°C (decompõe-se) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 121,2g/100ml (0°C); 126,7g/100ml (20°C); 179,6g/100ml (100°C) |
| Solubilidade | Solúvel em água, etanol, metanol |
| Pressão de vapor | Insignificante (anidro) |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | 4,5-7,5 (solução a 10%) |
Segurança e perigos do nitrato de cálcio
O nitrato de cálcio (Ca(NO3)2) pode representar vários perigos se não for manuseado adequadamente. É um forte agente oxidante que pode causar incêndio ou explosão se entrar em contato com materiais combustíveis. O composto também pode causar irritação na pele e nos olhos em contato, e a inalação de poeira pode causar irritação no trato respiratório. O Ca(NO3)2 deve ser armazenado em local fresco e seco, longe de fontes de calor e não deve ser misturado com outros produtos químicos sem as devidas precauções. Equipamentos de proteção individual, como luvas e proteção para os olhos, devem ser usados ao manusear Ca(NO3)2 para evitar contato com a pele ou os olhos. Em caso de ingestão acidental deve-se procurar atendimento médico imediatamente.
| Símbolos de perigo | Agente oxidante (GHS05), Irritante (GHS07) |
| Descrição de segurança | S22: Não respirar poeiras/fumos/gases/névoas/vapores/aerossóis. S26: Em caso de contato com os olhos, lavar imediata e abundantemente com água e consultar um médico. S36/37/39: Use roupas de proteção, luvas e proteção para os olhos/face adequados. |
| Identificadores AN | UN1454 (nitrato de cálcio anidro), UN1455 (nitrato de cálcio tetrahidratado) |
| Código SH | 283429 |
| Classe de perigo | 5.1 (Agentes oxidantes) |
| Grupo de embalagem | III |
| Toxicidade | Oral (LD50): 3.420 mg/kg (rato); Dérmico (LD50): > 5.000 mg/kg (coelho); Inalação (LC50): >4,8 mg/l/4h (rato) |
Métodos de síntese de nitrato de cálcio
Existem vários métodos para sintetizar Ca(NO3)2 dependendo da aplicação específica e da pureza desejada.
Um método comum é reagir carbonato de cálcio com ácido nítrico para produzir Ca(NO3)2 e dióxido de carbono:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Outro método é reagir hidróxido de cálcio com ácido nítrico :
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
A reação entre o ácido nítrico e o óxido de cálcio dá Ca(NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
O Ca(NO3)2 resultante pode ser ainda purificado por recristalização ou pela adição de uma pequena quantidade de ácido sulfúrico para remover impurezas como ferro e alumínio.
Os fabricantes podem produzir Ca(NO3)2 pela reação do cálcio metálico com ácido nítrico ou pela reação do hidróxido de cálcio com nitrato de amônio. No entanto, eles usam esses métodos com menos frequência devido ao custo mais elevado ou às preocupações de segurança associadas aos metais reativos ou ao nitrato de amônio.
Usos do nitrato de cálcio
- Usado como fertilizante na agricultura para fornecer às plantas nutrientes de cálcio e nitrogênio para o crescimento.
- Utilizado como componente em diversos tipos de concreto e cimento para melhorar sua resistência e durabilidade.
- Usado como aditivo na produção de produtos químicos para tratamento de águas residuais para ajudar a remover compostos de fósforo e nitrogênio da água.
- Utilizado na produção de diversos tipos de explosivos e fogos de artifício devido às suas propriedades oxidantes.
- Utilizado como fonte de cálcio e nitrogênio na produção de diversos produtos químicos, como náilon e outras fibras sintéticas.
- Usado como inibidor de corrosão para metais como alumínio e aço em aplicações industriais.
- Utilizado na conservação de carnes e como aditivo alimentar para melhorar a qualidade de determinados produtos alimentares.
- Utilizado na produção de bombas de fumaça e sinalizadores para aplicações militares e civis.
- Utilizado na fabricação de certos fertilizantes. Também usado em combinação com outros compostos para fornecer um fornecimento equilibrado de nutrientes às culturas.
- Usado como componente em alguns fertilizantes especiais para aquários para fornecer nutrientes essenciais às plantas aquáticas.
Questões:
P: Qual é o nome do Ca(NO3)2?
R: O nome de Ca(NO3)2 é nitrato de cálcio.
P: O Ca(NO3)2 é solúvel em água?
R: Sim, Ca(NO3)2 é altamente solúvel em água. À temperatura ambiente, 100 gramas de água podem dissolver até 121 gramas de nitrato de cálcio.
P: Onde comprar nitrato de cálcio?
R: O Ca(NO3)2 pode ser adquirido de vários fornecedores de produtos químicos, online e em lojas. Alguns locais comuns para comprar Ca(NO3)2 incluem empresas de suprimentos científicos, lojas de suprimentos agrícolas e centros domésticos e de jardinagem. É importante garantir que o fornecedor seja confiável e que o produto seja de alta qualidade e adequado à aplicação pretendida.
