O nitrato de magnésio é um composto cristalino branco com a fórmula química Mg(NO3)2. É utilizado na produção de fertilizantes, explosivos e produtos pirotécnicos devido à sua alta reatividade e propriedades oxidantes.
| Nome IUPAC | Dinitrato de magnésio |
| Fórmula molecular | Mg(NO3)2 |
| Número CAS | 10377-60-3 |
| Sinônimos | Ácido nítrico, sal de magnésio; ONU 1474; Nitrato de magnésio (II); Sal de magnésio de ácido nítrico (2+) |
| InChI | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Fórmula de Nitrato de Magnésio
A fórmula química do nitrato de magnésio é Mg(NO3)2, o que indica que o composto contém um cátion magnésio (Mg²⁺) e dois ânions nitrato (NO₃⁻). Esta fórmula é usada para representar a estequiometria do composto em equações químicas e também para determinar o peso molecular e outras propriedades do nitrato de magnésio.
Massa molar de nitrato de magnésio
A massa molar do nitrato de magnésio, representada pela fórmula química Mg(NO3)2, é de aproximadamente 148,31 g/mol. Este valor pode ser calculado somando as massas atômicas de magnésio (24,31 g/mol), dois átomos de nitrogênio (28,02 g/mol cada) e seis átomos de oxigênio (16,00 g/mol cada) presentes no composto. Conhecer a massa molar é crucial para determinar a quantidade de nitrato de magnésio necessária para reações químicas ou preparação de soluções.
Ponto de ebulição do nitrato de magnésio
O Mg(NO3)2 tem um ponto de ebulição relativamente alto de cerca de 330°C (626°F) à pressão atmosférica. Este valor pode variar ligeiramente dependendo da pureza e concentração do composto. O ponto de ebulição do Mg(NO3)2 é importante em processos industriais que envolvem a produção de fertilizantes, explosivos e pirotecnia, bem como em experimentos de laboratório.
Ponto de fusão do nitrato de magnésio
O ponto de fusão do Mg(NO3)2, que é a temperatura na qual o composto sólido muda para o estado líquido, é de aproximadamente 89°C (192°F) para a forma anidra e 95°C (203° F) para a forma anidra. forma anidra. forma hexahidratada. A forma hexaidratada do Mg(NO3)2 é mais comumente utilizada devido à sua estabilidade e facilidade de manuseio. O ponto de fusão é uma propriedade física essencial usada para determinar a pureza do Mg(NO3)2, bem como em vários processos industriais.
Densidade de nitrato de magnésio g/ml
A densidade do Mg(NO3)2 varia dependendo da forma do composto. A forma anidra possui densidade de aproximadamente 2,3 g/cm³, enquanto a forma hexahidratada possui densidade de aproximadamente 1,46 g/cm³. A densidade do Mg(NO3)2 é um fator crucial na determinação do volume do composto necessário nas reações químicas, bem como no seu armazenamento e transporte.
Peso molecular do nitrato de magnésio
O peso molecular do Mg(NO3)2, que é a soma dos pesos atômicos de todos os elementos do composto, é de aproximadamente 148,31 g/mol. Este valor é importante em diversos cálculos químicos, nomeadamente para determinar a quantidade de Mg(NO3)2 necessária em reações ou na preparação de soluções.
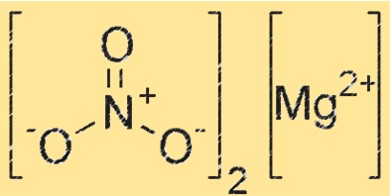
Estrutura do nitrato de magnésio
O Mg(NO3)2 possui uma estrutura cristalina que pertence ao sistema cristalino ortorrômbico. O composto consiste em cátions de magnésio (Mg²⁺) e ânions nitrato (NO₃⁻), com cada cátion de magnésio cercado por seis ânions nitrato em um arranjo octaédrico. A estrutura cristalina do Mg(NO3)2 desempenha um papel crucial na sua reatividade e propriedades.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,3 (anidro), 1,46 (hexahidrato) |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 148,31 g/mol |
| Densidade | 2,3 g/cm³ (anidro), 1,46 g/cm³ (hexahidrato) |
| Ponto de fusão | 89°C (anidro), 95°C (hexahidrato) |
| Ponto de ebulição | 330ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 234 g/L (anidro), 156 g/L (hexahidrato) a 20°C |
| Solubilidade | Solúvel em água, etanol, metanol |
| Pressão de vapor | 0,000009 mmHg a 20°C |
| Densidade do vapor | Não aplicável |
| pKa | 1,8 |
| pH | 4,5-6,0 (solução a 5%) |
Segurança e perigos do nitrato de magnésio
O Mg(NO3)2 pode representar vários riscos à segurança se não for manuseado adequadamente. Pode causar irritação e queimaduras na pele, olhos e vias respiratórias por contato ou inalação. O composto também é um forte agente oxidante e pode reagir violentamente com materiais orgânicos, incluindo substâncias inflamáveis e combustíveis. A inalação de poeira de Mg(NO3)2 pode causar irritação respiratória e até danos aos pulmões. Armazene e manuseie o Mg(NO3)2 em uma área fresca, seca e bem ventilada, longe de fontes de ignição. Ao manusear este composto, utilize equipamento de proteção individual adequado, como luvas e óculos de segurança.
| Símbolos de perigo | Agente oxidante |
| Descrição de segurança | Evite o contato com materiais combustíveis. Use equipamento de proteção individual. Manter afastado de fontes de ignição. |
| Identificadores AN | ONU 1474 |
| Código SH | 283429 |
| Classe de perigo | 5.1 (Agentes oxidantes) |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato): 3.500 mg/kg; LD50 (cutâneo, coelho): > 2.000 mg/kg. O nitrato de magnésio não é considerado cancerígeno, mutagênico ou teratogênico. |
Métodos de síntese de nitrato de magnésio
O nitrato de magnésio (Mg(NO3)2) pode ser sintetizado por vários métodos, incluindo a reação de óxido de magnésio ou hidróxido de magnésio com ácido nítrico.
Um método envolve adicionar óxido de magnésio a uma solução de ácido nítrico em um frasco e, em seguida, aquecer suavemente a mistura até que ela se dissolva. Para obter os cristais de Mg(NO3)2, filtre a solução para remover impurezas e evapore o solvente.
Outro método de síntese envolve a reação do magnésio metálico com ácido nítrico . Adicione tiras de magnésio ao ácido e deixe a reação continuar até que todo o metal se dissolva. Em seguida, evapore a solução obtida para obter os cristais de Mg(NO3)2.
Dissolva o carbonato de magnésio em ácido nítrico para formar Mg(NO3)2 e dióxido de carbono. Filtre a solução resultante e evapore-a para obter cristais de Mg(NO3)2.
Outro método é reagir o hidróxido de magnésio com ácido nítrico para produzir Mg(NO3)2 e água. A solução obtida é então purificada por filtração e evaporação para obter cristais de Mg(NO3)2.
Usos do nitrato de magnésio
O nitrato de magnésio tem muitos usos em diversas indústrias e aplicações. Alguns dos principais usos do Mg(NO3)2 são:
- Agricultura: Utilizado como fertilizante, principalmente para culturas que necessitam de altos níveis de magnésio, como tomate, pimentão e frutas cítricas. Ajuda a melhorar o crescimento das plantas e melhora a qualidade e o rendimento da colheita.
- Produtos Pirotécnicos: Utilizados como oxidante em fogos de artifício e outras aplicações pirotécnicas porque podem produzir chamas brilhantes e intensas e ajudar a controlar a taxa de queima.
- Produção de vidro: Usado como fundente na produção de vidro para diminuir o ponto de fusão do vidro e melhorar suas propriedades de fluxo.
- Síntese química: Usado como reagente em diversas reações de síntese química, como na produção de outros compostos de magnésio, catalisadores e produtos farmacêuticos.
- Preservação: Usado como conservante de alimentos para inibir o crescimento de bactérias e outros microorganismos.
- Aplicações industriais: Utilizado na produção de óxido e hidróxido de magnésio, que são utilizados como retardadores de chama, no tratamento de águas residuais e como agente neutralizante em solos ácidos.
- Pesquisa Laboratorial: Usado em vários experimentos e pesquisas laboratoriais, como preparação de soluções padrão e testes de procedimentos analíticos.
Questões:
P: O Mg (NO3) 2 é solúvel?
R: Sim, o nitrato de magnésio é muito solúvel em água.
P: Qual é a fórmula do nitrato de magnésio?
R: A fórmula do nitrato de magnésio é Mg(NO3)2.
P: Qual é a massa molar do Mg(NO3)2?
R: A massa molar do Mg(NO3)2 é 148,31 g/mol.
P: Qual é o peso da fórmula de Mg(NO3)2?
R: O peso da fórmula de Mg(NO3)2 é 148,31 g/mol.
P: Qual é o nome sistemático de Mg(NO3)2?
R: O nome sistemático do Mg(NO3)2 é dinitrato de magnésio.
P: Qual é a concentração de íons nitrato em uma solução 0,125 M de Mg(NO3)2?
R: A concentração de íons nitrato em uma solução 0,125 M de Mg(NO3)2 é 0,25 M, porque existem dois íons nitrato para cada íon magnésio.
P: Qual é a massa da fórmula de Mg(NO3)2?
R: A massa da fórmula de Mg(NO3)2 é 148,31 g/mol.
