O sulfato de zinco é um composto com a fórmula química ZnSO4. É comumente usado como suplemento dietético para tratar a deficiência de zinco e como fertilizante para plantações.
| Nome IUPAC | Sulfato de zinco |
| Fórmula molecular | ZnSO4 |
| Número CAS | 7733-02-0 |
| Sinônimos | Vitriol branco, Vitriol de zinco, Sulfato de zinco (II), Sulfato de zinco (2+), Monossulfato de zinco, Sulfato de zinco heptahidratado, Sulfato de zinco monohidratado |
| InChI | InChI=1S/2O.H2S.Zn/h2*1H;1H2;/q;;;+2/p-2 |
Fórmula de sulfato de zinco
A fórmula química do sulfato de zinco é ZnSO4. Consiste em um íon zinco (Zn2+) e um íon sulfato (SO42-). A fórmula mostra que o sulfato de zinco contém um átomo de zinco, um átomo de enxofre e quatro átomos de oxigênio.
Massa molar de sulfato de zinco
A massa molar do sulfato de zinco (ZnSO4) é 161,44 g/mol. É a soma das massas atômicas de todos os átomos presentes em um mol do composto. O sulfato de zinco é composto por um átomo de zinco (Zn), um átomo de enxofre (S) e quatro átomos de oxigênio (O). A massa molar é um parâmetro essencial usado em cálculos estequiométricos para determinar a quantidade de reagentes e produtos em uma reação química.
Ponto de ebulição do sulfato de zinco
O sulfato de zinco não tem ponto de ebulição definido porque se decompõe antes de atingir o ponto de ebulição. O composto sofre decomposição térmica a aproximadamente 680°C, formando gases óxido de zinco (ZnO), dióxido de enxofre (SO2) e oxigênio (O2). A temperatura de decomposição é afetada pela presença de impurezas, pressão e taxa de aquecimento. O sulfato de zinco é estável em baixas temperaturas e é solúvel em água, metanol e etanol.
Ponto de fusão do sulfato de zinco
O ponto de fusão do sulfato de zinco depende do nível de hidratação do composto. O sulfato de zinco heptahidratado (ZnSO4.7H2O) tem um ponto de fusão de 100°C, enquanto o sulfato de zinco monohidratado (ZnSO4.H2O) derrete a 70°C. O sulfato de zinco anidro (ZnSO4) se decompõe antes de derreter. O ponto de fusão é influenciado por fatores como pressão, pureza e taxa de aquecimento.
Densidade de sulfato de zinco g/ml
A densidade do sulfato de zinco varia dependendo do seu estado de hidratação. O sulfato de zinco heptahidratado tem densidade de 1,957 g/cm³, o sulfato de zinco monohidratado tem densidade de 3,08 g/cm³ e o sulfato de zinco anidro tem densidade de 3,54 g/cm³. A densidade é uma propriedade física que determina a quantidade de massa por unidade de volume de uma substância. A densidade do sulfato de zinco também é afetada pela temperatura e pressão.
Peso molecular do sulfato de zinco
O peso molecular do sulfato de zinco é 161,44 g/mol. É calculado somando os pesos atômicos de zinco, enxofre e oxigênio, que são 65,38 g/mol, 32,06 g/mol e 63,998 g/mol, respectivamente. O peso molecular é usado em vários cálculos, como na determinação da concentração de soluções de sulfato de zinco em experimentos de química e biologia.
Estrutura do sulfato de zinco
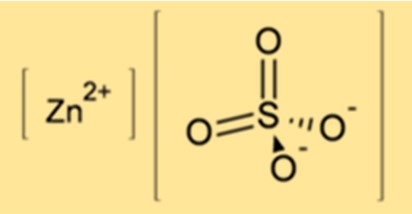
O sulfato de zinco possui estrutura cristalina em sua forma anidra, com cátions de zinco (Zn2+) e ânions sulfato (SO42-) dispostos alternadamente. O cátion zinco é coordenado por seis átomos de oxigênio de seis ânions sulfato, formando uma geometria octaédrica distorcida. Na forma hidratada, o sulfato de zinco heptahidratado forma cristais monoclínicos, enquanto o sulfato de zinco monohidratado forma cristais ortorrômbicos. As moléculas de água contidas nos hidratos estão fracamente ligadas à rede de sulfato de zinco por ligações de hidrogênio.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 3,54 g/cm³ (anidro) |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 161,44 g/mol |
| Densidade | 1,957 g/cm³ (heptahidrato), 3,08 g/cm³ (monohidrato), 3,54 g/cm³ (anidro) |
| Ponto de fusão | 70°C (monohidrato), 100°C (heptahidrato) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água, metanol e etanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | pKa1=1,9, pKa2=3,1, pKa3=9,8 |
| pH | O pH da solução 0,1 M é 4,2 |
Segurança e perigos do sulfato de zinco
O sulfato de zinco é geralmente seguro de manusear quando usado de acordo com as instruções. No entanto, pode causar irritação nos olhos, pele e sistema respiratório em contato. A ingestão de grandes quantidades pode causar náuseas, vômitos e diarreia. A exposição prolongada ao pó de sulfato de zinco pode causar irritação respiratória ou febre por vapores metálicos. É importante usar equipamentos de proteção individual (EPI) adequados, como luvas e óculos de proteção, ao manusear o sulfato de zinco. Em caso de exposição acidental, lave as áreas afetadas com bastante água e enxágue, se necessário, consulte um médico. Armazene o sulfato de zinco em um recipiente bem fechado e longe de substâncias incompatíveis.
| Símbolos de perigo | XI |
| Descrição de segurança | Mantenha fora do alcance de crianças. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. SE ENTRAR EM CONTACTO COM OS OLHOS: enxaguar cuidadosamente com água durante vários minutos. Remova as lentes de contato, se presentes e fáceis de retirar. Continue enxaguando. EM CASO DE INGESTÃO: Enxágue a boca. NÃO induza o vômito. Obtenha aconselhamento/atenção médica se não se sentir bem. Descarte o conteúdo/recipiente de acordo com os regulamentos locais/regionais/nacionais/internacionais. |
| Identificadores AN | Não regulamentado |
| Código SH | 2833.29.90 |
| Classe de perigo | 9 – Mercadorias perigosas diversas |
| Grupo de embalagem | III |
| Toxicidade | O sulfato de zinco é geralmente considerado de baixa toxicidade. No entanto, a ingestão de grandes quantidades pode causar irritação gastrointestinal e provocar vómitos, diarreia e desidratação. A inalação de poeira ou névoa pode irritar o trato respiratório. O sulfato de zinco pode causar irritação nos olhos e na pele em contato. A exposição prolongada a altos níveis de pó de sulfato de zinco pode causar febre dos vapores metálicos. |
Métodos de síntese de sulfato de zinco
Existem vários métodos para sintetizar sulfato de zinco, dependendo da pureza desejada, tamanho de partícula e nível de hidratação do produto final. Um método comum envolve a reação de zinco metálico ou óxido de zinco com ácido sulfúrico:
1. Zinco metálico + ácido sulfúrico → sulfato de zinco + gás hidrogênio
2. Óxido de zinco + ácido sulfúrico → Sulfato de zinco + água
Para otimizar o rendimento e a pureza do sulfato de zinco, a reação deve ser realizada sob condições controladas de temperatura, agitação e concentração de ácido. Depois disso, aplique outras etapas de processamento, como cristalização, secagem e peneiração, à solução de sulfato de zinco resultante para atingir o tamanho de partícula e o nível de hidratação desejados.
Outro método de produção de sulfato de zinco envolve a reação de minério ou concentrado de zinco com ácido sulfúrico:
3. Minério/concentrado de zinco + ácido sulfúrico → sulfato de zinco + sulfato de ferro + água
O sulfato de zinco pode ser separado do sulfato de ferro e outras impurezas usando técnicas como filtração, precipitação ou extração com solvente.
Para produzir sulfato de zinco, o carbonato de zinco ou o hidróxido de zinco podem reagir com ácido sulfúrico, ou a cinza de zinco pode ser oxidada com ácido sulfúrico.
A escolha do método depende de fatores como disponibilidade de matéria-prima, custo e especificações do produto.
Usos do sulfato de zinco
O sulfato de zinco possui uma ampla gama de aplicações industriais, agrícolas e médicas devido às suas propriedades únicas. Aqui estão alguns usos comuns do sulfato de zinco:
- Fertilizante: Usado como fertilizante de micronutrientes que fornece zinco essencial às plantas para um crescimento e desenvolvimento saudáveis.
- Alimentação Animal: Adicionado à alimentação animal como suplemento nutricional para prevenir a deficiência de zinco e melhorar a saúde geral.
- Tratamento de Água: Utilizado em estações de tratamento de água para remover impurezas e reduzir a turbidez.
- Galvanização: Utilizado no processo de galvanização, que envolve o revestimento do ferro e do aço com uma camada de zinco para evitar a corrosão.
- Remédio: Usado medicinalmente como suplemento dietético para tratar a deficiência de zinco, bem como em pomadas tópicas para tratar doenças de pele como eczema e acne.
- Tingimento: Utilizado em tingimento e estamparia têxtil para melhorar a solidez da cor e o brilho dos corantes.
- Galvanoplastia: Usado em galvanoplastia para depositar uma camada de zinco em superfícies metálicas para proteção contra corrosão e fins decorativos.
- Retardador de chama: Usado como retardador de chama em plásticos, borracha e outros materiais para reduzir o risco de incêndio.
- Outros usos: Utilizado na produção de pigmentos, papéis, sabões e detergentes.
Questões:
P: O que você observaria quando o zinco fosse adicionado a uma solução de sulfato de ferro?
R: Quando o zinco é adicionado a uma solução de sulfato de ferro, ocorre uma reação de deslocamento. O zinco mais reativo desloca o ferro menos reativo da solução de sulfato, formando sulfato de zinco e ferro metálico. A reação pode ser observada como a formação de um sólido marrom-avermelhado e a liberação de gás hidrogênio.
P: O que acontece quando um pedaço de zinco é adicionado a uma solução de sulfato de cobre?
R: Quando um pedaço de zinco metálico é adicionado a uma solução de sulfato de cobre, ocorre uma reação de deslocamento. O zinco é mais reativo que o cobre, por isso desloca o cobre da solução de sulfato, formando sulfato de zinco e um sólido marrom-avermelhado de cobre metálico. A reação pode ser observada quando a solução fica azul à medida que íons de cobre são liberados na solução e a formação de um depósito sólido de cobre na superfície do zinco metálico.
P: O sulfato de zinco é um sal?
R: Sim, o sulfato de zinco é um sal composto por íons zinco (Zn2+) e íons sulfato (SO42-). É um composto cristalino branco com a fórmula ZnSO4 e é comumente usado em diversas aplicações, como fertilizantes, ração animal e medicamentos.
P: Onde comprar pó de sulfato de zinco?
R: O pó de sulfato de zinco pode ser adquirido em fornecedores de produtos químicos, varejistas on-line e lojas de materiais agrícolas. É importante garantir que o produto seja de alta qualidade e adequado ao uso pretendido.
P: O sulfato de zinco é solúvel?
R: Sim, o sulfato de zinco é solúvel em água e glicerol. A solubilidade do sulfato de zinco varia com a temperatura, com maior solubilidade em temperaturas mais altas. A solubilidade também pode ser afetada pela presença de outros íons na solução.
P: Para que é usado o sulfato de zinco?
R: O sulfato de zinco tem diversas aplicações, incluindo seu uso como fertilizante, suplemento de ração animal, agente de tratamento de água, medicamento e na produção de pigmentos, papel e têxteis. Também é usado em galvanoplastia, em retardadores de chama e como suplemento dietético para tratar a deficiência de zinco e apoiar a saúde geral.
