Trifluoreto de cloro ou ClF3 é um composto químico altamente reativo e tóxico usado em propulsores de foguetes, agentes de limpeza e como agente oxidante em reações químicas. Pode causar queimaduras graves e inflamar-se espontaneamente em contato com materiais orgânicos.
| Nome IUPAC | Trifluoreto de cloro |
| Fórmula molecular | ClF3 |
| Número CAS | 7790-91-2 |
| Sinônimos | Fluoreto de cloro, trifluorocloro, triclorofluoreto, fluorocloro, fluoreto de cloril, cloreto de flúor |
| InChI | InChI=1S/ClF3/c2-1(3)4 |
Fórmula de trifluoreto de cloro
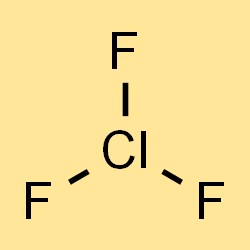
A fórmula química do trifluoreto de cloro é ClF3, que representa os três átomos de flúor e um átomo de cloro na molécula. A fórmula pode ser usada para calcular a massa molar, densidade e outras propriedades físicas do trifluoreto de cloro. A fórmula também indica os tipos e a quantidade de átomos presentes no composto, o que é importante para a compreensão de suas propriedades químicas e reatividade.
Massa molar de trifluoreto de cloro
A massa molar do trifluoreto de cloro (ClF3) é 92,45 g/mol. Este valor é calculado somando os pesos atômicos dos elementos constituintes, que são 35,45 g/mol para o cloro e 37,996 g/mol para o flúor. A massa molar do trifluoreto de cloro é importante nos cálculos químicos e na determinação da quantidade do composto em uma determinada amostra.
Ponto de ebulição do trifluoreto de cloro
O trifluoreto de cloro tem um ponto de ebulição de 11,75°C à pressão padrão. Isso o torna um composto volátil e altamente reativo que pode facilmente vaporizar e formar vapores tóxicos. O baixo ponto de ebulição do trifluoreto de cloro é atribuído às fracas forças intermoleculares entre suas moléculas, permitindo que elas se quebrem e escapem como gás em temperaturas relativamente baixas.
Ponto de fusão do trifluoreto de cloro
O trifluoreto de cloro tem um ponto de fusão de -76,3°C (-105,3°F) à pressão padrão. Isso o torna sólido à temperatura e pressão ambientes, mas pode facilmente sublimar e formar vapores tóxicos devido à sua alta volatilidade. O baixo ponto de fusão do trifluoreto de cloro é atribuído às fracas forças intermoleculares entre suas moléculas, o que permite que elas se quebrem e se tornem um gás em temperaturas relativamente baixas.
Densidade de trifluoreto de cloro g/ml
A densidade do trifluoreto de cloro é 1,77 g/mL em temperatura e pressão padrão (STP). Esse valor é superior ao do ar (1,29 g/mL), o que torna o trifluoreto de cloro um gás mais denso que o ar. A alta densidade do trifluoreto de cloro se deve ao seu peso molecular, que é superior ao da maioria dos gases da atmosfera.
Peso molecular do trifluoreto de cloro
O peso molecular do trifluoreto de cloro é 92,45 g/mol. Este valor é calculado somando os pesos atômicos dos elementos constituintes, que são 35,45 g/mol para o cloro e 37,996 g/mol para o flúor. O alto peso molecular do trifluoreto de cloro o torna um gás denso, mais pesado que o ar.
Estrutura do trifluoreto de cloro
O trifluoreto de cloro tem uma geometria molecular bipiramidal trigonal, com um átomo de cloro central ligado a três átomos de flúor em posições equatoriais e dois sítios vagos em posições axiais. Esta estrutura dá origem a uma molécula polar, com as duas posições axiais tendo carga parcial positiva e as três posições equatoriais tendo carga parcial negativa.
| Aparência | Gás ou líquido incolor a amarelo pálido |
| Gravidade Específica | 1,77 |
| Cor | Incolor a amarelo pálido |
| Cheiro | Odor pungente e sufocante |
| Massa molar | 92,45 g/mol |
| Densidade | 1,77 g/mL nas CNTP |
| Ponto de fusão | -76,3°C (-105,3°F) |
| Ponto de ebulição | 11,75ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage violentamente com água |
| Solubilidade | Solúvel em ácido sulfúrico, ácido nítrico e outros agentes oxidantes |
| Pressão de vapor | 1,73 ATM a 20°C |
| Densidade do vapor | 3,2 (ar = 1) |
| PKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do trifluoreto de cloro
O trifluoreto de cloro é um composto altamente reativo e perigoso. Isso representa sérios riscos à saúde e à segurança e deve ser tratado com extremo cuidado. Pode causar queimaduras graves, corrosão e irritação em contato com a pele, olhos e mucosas. A inalação de seus vapores pode causar dificuldade respiratória, tosse e dor no peito. O trifluoreto de cloro também pode inflamar e reagir violentamente com materiais orgânicos, metais e água, causando explosões e incêndios. Equipamentos de proteção especializados, como roupas resistentes a produtos químicos e respiradores, devem ser usados ao manusear trifluoreto de cloro e só devem ser usados em ambiente bem ventilado e controlado por profissionais treinados.
| Símbolos de perigo | Corrosivo, Oxidante |
| Descrição de segurança | Manter afastado do calor, faíscas, chamas abertas, superfícies quentes e fontes de ignição. Use roupas e equipamentos de proteção. Evite contato com a pele, olhos e roupas. Não inale fumos ou vapores. Não ingira. Use apenas em uma área bem ventilada. |
| Identificadores AN | Um 1749 |
| Código SH | 281211 |
| Classe de perigo | 8 |
| Grupo de embalagem | EU |
| Toxicidade | Muito tóxico |
Métodos para a síntese de trifluoreto de cloro
A fluoração direta do gás cloro pode sintetizar trifluoreto de cloro. O fluoreto de hidrogênio e o cloro gasoso podem reagir para sintetizar o trifluoreto de cloro.
Uma mistura de gás cloro e gás flúor reage em um leito de carvão ativado ou outro material inerte em alta temperatura para produzir trifluoreto de cloro no método de fluoração direta.
Outro método envolve a reação entre fluoreto de hidrogênio e cloro gasoso. Neste método, ambos os gases passam sobre um catalisador, como alumina ativada ou platina, a temperaturas elevadas. A reação entre os dois gases produz trifluoreto de cloro e cloreto de hidrogênio como subprodutos.
O tetrafluoreto de enxofre e o gás cloro reagem na presença de um catalisador, como ferro ou níquel, em temperaturas elevadas para sintetizar trifluoreto de cloro e produzir dióxido de enxofre como subproduto.
Equipamento especializado e manuseio cuidadoso são necessários para cada um desses métodos devido à natureza perigosa do trifluoreto de cloro. A segurança do pessoal e do ambiente deve ser garantida durante o processo de síntese através de medidas de segurança adequadas, tais como fatos resistentes a produtos químicos e sistemas de ventilação.
Usos do trifluoreto de cloro
O trifluoreto de cloro (ClF3) tem diversas aplicações industriais devido à sua natureza altamente reativa e fortes propriedades oxidantes.
- O ClF3 limpa e grava materiais semicondutores, como silício e germânio, removendo contaminantes e impurezas indesejados de suas superfícies.
- O ClF3 converte óxido de urânio em hexafluoreto de urânio para produção de combustível nuclear. O hexafluoreto de urânio é enriquecido para uso em reatores nucleares.
- O ClF3 aumenta a eficiência da combustão e gera maior empuxo quando usado em combinação com outros agentes oxidantes, como hidrazina ou hidrogênio em propulsores de foguetes e oxidantes de alta energia para sistemas de combustível.
- ClF3 branqueia têxteis e produtos de papel.
- O ClF3 produz certos produtos químicos, como gás flúor e fluorocarbonos.
Devido à sua natureza perigosa, o trifluoreto de cloro deve ser manuseado com extremo cuidado em todas as suas aplicações e somente por profissionais treinados e com equipamentos e protocolos de segurança adequados.
Questões:
P: O trifluoreto de cloro é polar ou apolar?
R: O trifluoreto de cloro é uma molécula polar devido à diferença de eletronegatividade entre os átomos de cloro e flúor.
P: Como extinguir o trifluoreto de cloro?
R: O trifluoreto de cloro pode ser extinto com areia seca, grafite ou cloreto de sódio. A água nunca deve ser usada para extinguir um incêndio de trifluoreto de cloro, pois pode reagir violentamente e liberar gases tóxicos.
P: Estrutura de Lewis do trifluoreto de cloro?
R: A estrutura de Lewis do ClF3 consiste em um átomo central de cloro rodeado por três átomos de flúor. O átomo de cloro está ligado a cada um dos três átomos de flúor por uma ligação simples, e há um único par de elétrons no átomo de cloro.
P: Qual é a carga formal do átomo de cloro na molécula de trifluoreto de cloro?
R: A carga formal do átomo de cloro no trifluoreto de cloro é zero. O átomo de cloro possui sete elétrons de valência e está ligado a três átomos de flúor, que possuem eletronegatividade maior que o cloro. O par solitário de elétrons no átomo de cloro não está envolvido em nenhuma ligação e, portanto, não é levado em consideração na determinação da carga formal.
P: Incêndio de trifluoreto de cloro?
R: O trifluoreto de cloro é uma substância altamente reativa e inflamável que pode inflamar-se espontaneamente ao entrar em contato com materiais orgânicos ou até mesmo com o ar. No caso de incêndio com trifluoreto de cloro, deve-se usar areia seca, grafite ou cloreto de sódio para extinguir o incêndio, e nunca deve-se usar água, pois pode causar uma reação violenta. Evacuar a área e procurar atendimento médico imediato se exposto também é crucial no caso de incêndio de trifluoreto de cloro.
