O ácido fórmico ou HCOOH é um líquido incolor com odor pungente. É amplamente utilizado como conservante e agente antibacteriano e na fabricação de couro, têxteis e borracha.
| Nome IUPAC | Ácido metanóico |
| Fórmula molecular | HCOOH |
| Número CAS | 64-18-6 |
| Sinônimos | Ácido carboxílico de hidrogênio, ácido formil, aminoácido, ácido formil, ácido metacarbônico, ácido tionilfórmico, etc. |
| InChI | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
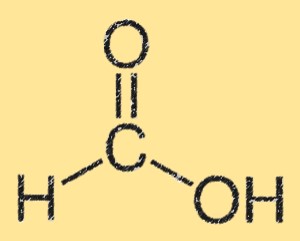
Estrutura do ácido fórmico
A estrutura do ácido fórmico é caracterizada por um grupo ácido carboxílico (-COOH) ligado a um único átomo de carbono. O átomo de carbono também está ligado a um átomo de hidrogênio e a um átomo de oxigênio. A estrutura do ácido fórmico é plana e possui ligações de hidrogênio entre os grupos de ácido carboxílico. A ligação de hidrogênio dá origem à sua alta solubilidade em água.
Fórmula de ácido fórmico
A fórmula química do ácido fórmico é HCOOH. É um composto orgânico simples que contém um átomo de carbono, um átomo de oxigênio e dois átomos de hidrogênio. A fórmula do ácido fórmico é importante na determinação de suas propriedades químicas e físicas, bem como de seu comportamento em diversas condições. Também é usado em vários cálculos químicos, como estequiometria e molaridade.
Estrutura de Lewis HCOOH
A estrutura de Lewis do ácido fórmico (HCOOH) é a seguinte:
H
|
C=O
|
OH
O átomo de carbono está no centro da estrutura com quatro elétrons de valência. Forma ligações simples com os dois átomos de hidrogênio e o átomo de oxigênio, que possui dois pares de elétrons livres. O átomo de oxigênio também forma uma ligação dupla com o outro átomo de carbono, que carrega um par de elétrons livres. A estrutura de Lewis mostra que a molécula possui uma ligação covalente polar devido à diferença de eletronegatividade entre os átomos de carbono e oxigênio.
Massa molar de ácido fórmico
A massa molar do ácido fórmico, também chamado de ácido metanóico, é 46,03 g/mol. Sua fórmula química é HCOOH, o que indica que contém um átomo de carbono, um átomo de oxigênio e dois átomos de hidrogênio. A massa molar é um parâmetro importante para determinar a quantidade de uma substância necessária para preparar uma solução com uma concentração específica. Por exemplo, para preparar uma solução 1 M de ácido fórmico, seria necessário dissolver 46,03 g de ácido fórmico em 1 litro de solvente.
Ponto de ebulição do ácido fórmico
O ponto de ebulição do HCOOH é 100,8°C (213,4°F). É um líquido incolor, de odor pungente e muito solúvel em água. O ponto de ebulição do HCOOH é relativamente baixo, o que significa que pode ser facilmente vaporizado e destilado. Esta propriedade o torna útil em diversas aplicações industriais, como produção de corantes, plásticos e produtos farmacêuticos.
Ponto de fusão HCOOH
O ponto de fusão do HCOOH é 8,4°C (47,1°F). É um sólido à temperatura ambiente e pode ser obtido na sua forma pura arrefecendo-o abaixo do seu ponto de fusão. Os cristais de HCOOH são brancos e exalam um odor pungente. O ponto de fusão do HCOOH é relativamente baixo em comparação com outros ácidos carboxílicos, tornando-o um solvente útil para certas reações químicas.
Densidade HCOOH g/mL
A densidade do HCOOH é 1.220 g/mL a 25°C (77°F). É mais denso que a água, que tem densidade de 1000 g/mL na mesma temperatura. A densidade do HCOOH é uma propriedade importante que determina sua solubilidade em água e outros solventes. Isto também afeta seu comportamento sob diferentes condições, como temperatura e pressão.
Peso molecular do ácido fórmico
O peso molecular do ácido fórmico é 46,03 g/mol. É um composto orgânico simples com a fórmula química HCOOH. O peso molecular é um parâmetro importante para determinar as propriedades físicas e químicas de uma substância. É usado para calcular várias quantidades, como número de moles, massa e volume de uma substância.
| Aparência | Líquido incolor |
| Gravidade Específica | 1.22 |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 46,03 g/mol |
| Densidade | 1.220g/ml |
| Ponto de fusão | 8,4ºC |
| Ponto de ebulição | 100,8ºC |
| Ponto flash | 68°C |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel na maioria dos solventes orgânicos |
| Pressão de vapor | 44,5mmHg |
| Densidade do vapor | 1,5 (ar=1) |
| pKa | 3,75 |
| pH | 2.4 |
Segurança e perigos do ácido fórmico
O HCOOH apresenta vários riscos de segurança e perigos. É uma substância altamente corrosiva e tóxica que pode causar queimaduras graves na pele e lesões oculares ao entrar em contato. A inalação de vapores de HCOOH pode causar irritação respiratória e danos nos pulmões. Também é inflamável e pode inflamar-se a altas temperaturas, representando risco de incêndio. Devem ser tomadas precauções de segurança adequadas ao manusear HCOOH, incluindo o uso de roupas de proteção, luvas e proteção para os olhos. Deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis, como agentes oxidantes e álcalis.
| Símbolos de perigo | Corrosivo, Tóxico |
| Descrição de segurança | Use luvas de proteção e proteção para os olhos/face. Em caso de contato com os olhos, lavar imediatamente com água em abundância e enxaguar com médico. |
| Números de identificação da ONU | ONU1779 |
| Código SH | 2915.11.00 |
| Classe de perigo | 8 (Corrosivo) |
| Grupo de embalagem | II (Intermediário) |
| Toxicidade | LD50 1,8 g/kg (oral, rato) |
Métodos para a síntese de ácido fórmico
O ácido fórmico pode ser sintetizado por vários métodos.
- Um método comum envolve a reação de monóxido de carbono e água na presença de um catalisador, como ródio ou cobalto. Este é o processo Formox. Este processo produz ácido fórmico e gás hidrogênio.
- Outro método envolve a oxidação do formaldeído utilizando um agente oxidante forte, como ácido crômico ou permanganato de potássio, sob condições ácidas. Esta reação produz ácido fórmico e água.
- Uma maneira de sintetizar o ácido fórmico é reagir o formato de sódio com ácido sulfúrico. Esta reação resulta na formação de ácido fórmico e sulfato de sódio como subproduto.
- As formigas produzem ácido fórmico como mecanismo de defesa natural e pode ser obtido de seus corpos por meio de destilação.
- Outro método de síntese de HCOOH envolve a reação de dióxido de carbono com hidrogênio na presença de um catalisador, como cromita de cobre ou óxido de zinco. Este processo, conhecido como reação de síntese de HCOOH, produz HCOOH e água.
- O HCOOH também pode ser obtido de fontes naturais, como folhas de urtiga, onde está presente em pequenas quantidades.
No geral, existem vários métodos disponíveis para a síntese de HCOOH, cada um com suas vantagens e desvantagens.
Usos do ácido fórmico
O ácido fórmico tem uma ampla gama de aplicações em diversas indústrias.
- Sua capacidade de prevenir o crescimento de microorganismos nocivos torna o ácido fórmico uma escolha comum como conservante e agente antibacteriano na alimentação animal e na silagem.
- Ajuda a prevenir o crescimento de microorganismos nocivos em rações e silagem, tornando-se um aditivo útil.
- A indústria têxtil utiliza ácido fórmico como agente de tingimento e acabamento de tecidos para melhorar a solidez da cor e aumentar a afinidade dos corantes com as fibras.
- O ácido fórmico serve como solvente e intermediário na produção de diversos produtos químicos, como ácido acético, formamida e metanol.
- O ácido fórmico é um agente curtente utilizado na indústria do couro que ajuda a melhorar a textura e a durabilidade dos produtos de couro.
- Na produção de borracha, o ácido fórmico auxilia no processo de vulcanização servindo como coagulante.
- A indústria farmacêutica utiliza ácido fórmico como conservante de vacinas e como desinfetante de equipamentos médicos.
- Além disso, o ácido fórmico encontra aplicações na produção de diversos medicamentos, incluindo diuréticos e anti-histamínicos.
- O ácido fórmico é um agente redutor em reações de síntese orgânica e um catalisador em reações de polimerização.
- O ácido fórmico ajuda a realçar o aroma de diversos produtos, tornando-o útil na produção de sabores e fragrâncias.
No geral, a diversidade de aplicações do ácido fórmico em diversas indústrias se deve às suas propriedades únicas e natureza versátil.
Questões:
P. O ácido fórmico é um ácido forte?
R. O ácido fórmico é um ácido fraco, com um valor de pKa de aproximadamente 3,75. Isto significa que não se dissocia completamente em água e é um ácido mais fraco do que ácidos fortes, como o ácido clorídrico ou o ácido sulfúrico.
P. Qual é o ácido fórmico ou acético mais ácido?
R. O ácido fórmico é mais ácido que o ácido acético. Isto se deve à presença de um grupo metil no ácido acético que estabiliza a carga negativa da base conjugada, tornando menos provável sua dissociação. Por outro lado, o ácido fórmico tem um tamanho molecular menor e um átomo eletronegativo mais forte (oxigênio), o que facilita sua dissociação e o torna mais ácido.
P. O ácido fórmico é produzido por qual formiga?
R. O ácido fórmico é produzido por várias espécies de formigas, incluindo formigas de madeira, formigas de fogo e algumas espécies de abelhas sem ferrão. O ácido é armazenado no corpo da formiga e é utilizado como mecanismo de defesa contra predadores. Quando ameaçada, a formiga pode disparar ácido fórmico de seu ferrão ou liberá-lo de glândulas especializadas em seu corpo.
