O hidróxido de bário é um composto químico com a fórmula Ba(OH)2. É um sólido cristalino branco, altamente solúvel em água e comumente utilizado em laboratórios e processos industriais.
| Nome IUPAC | Dihidróxido de bário |
| Fórmula molecular | Ba(OH)2 |
| Número CAS | 17194-00-2 |
| Sinônimos | Hidróxido de bário (II), barita, hidrato de bário, di-hidrato de bário, bis (hidróxido de bário), bis (oxidanil) hidrato de bário |
| InChI | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Massa molar de hidróxido de bário
O hidróxido de bário tem massa molar de 171,34 g/mol. É composto por um íon bário (Ba2+) e dois íons hidróxido (OH-), cada um com massa molar de 137,33 g/mol e 17,01 g/mol, respectivamente. A massa molar do hidróxido de bário é importante para determinar a quantidade de composto necessária para reações ou para calcular a concentração de uma solução.
Fórmula de hidróxido de bário
A fórmula química do hidróxido de bário é Ba(OH)2. Consiste em um íon bário (Ba2+) e dois íons hidróxido (OH-). A fórmula do hidróxido de bário é importante para determinar a quantidade de composto necessária nas reações ou para calcular a concentração de uma solução. Também é usado para representar a estrutura do composto e seu comportamento em solução.
Ponto de ebulição do Ba(OH)2
O ponto de ebulição do Ba(OH)2 não está bem definido, porque ele se decompõe antes de ser fervido. Ba(OH)2 é uma base forte e reage facilmente com o dióxido de carbono do ar, formando carbonato de bário e água. A temperatura de decomposição do Ba(OH)2 depende da concentração da solução, mas geralmente é superior a 780°C.
Ponto de fusão Ba(OH)2
Ba(OH)2 tem um ponto de fusão de 407°C. Existe no estado sólido na forma de cristais brancos e inodoros. Quando aquecido, o Ba(OH)2 sofre uma reação reversível para formar óxido de bário e água. O ponto de fusão do Ba(OH)2 é importante para determinar a temperatura na qual ele pode ser manuseado e armazenado com segurança.
Densidade de Ba(OH)2 g/ml
A densidade do sólido Ba(OH)2 é 3,22 g/cm3. Em solução, a densidade varia dependendo da concentração. Por exemplo, uma solução de Ba(OH)2 a 10% tem uma densidade de 1,17 g/cm3. A densidade do Ba(OH)2 é importante na determinação do volume de uma solução necessária para as reações ou no manuseio do composto.
Peso molecular de Ba(OH)2
O peso molecular de Ba(OH)2 é 171,34 g/mol. É a soma dos pesos atômicos de um íon bário e dois íons hidróxido. O peso molecular do Ba(OH)2 é importante para determinar a quantidade de composto necessária nas reações ou para calcular a concentração de uma solução.
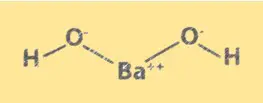
Estrutura Ba(OH)2
Ba(OH)2 tem uma estrutura cristalina semelhante ao cloreto de sódio. Consiste em íons Ba2+ e íons OH-, dispostos em uma rede cúbica. Os íons Ba2+ ocupam os cantos do cubo e os íons OH- ocupam o centro de cada face. A estrutura do Ba(OH)2 é importante para a compreensão de suas propriedades químicas e comportamento em solução.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 3,22 g/cm3 (sólido) |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 171,34 g/mol |
| Densidade | 2,18 g/cm3 (solução aquosa, 10% p/p a 25°C) |
| Ponto de fusão | 407°C |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel em água |
| Solubilidade | Solúvel em álcool e acetona |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Alcalino (pH > 7) |
Nota: Os valores fornecidos nesta tabela são descrições gerais e podem variar dependendo das condições e concentrações específicas da substância.
Segurança e perigos do hidróxido de bário
Ba(OH)2 é uma substância altamente cáustica e tóxica que pode causar irritação grave na pele, olhos e trato respiratório. É importante manuseá-lo com cuidado e usar equipamentos de proteção individual adequados, como luvas e óculos de segurança. Se inalado ou ingerido, pode causar sérios danos aos pulmões, sistema digestivo e rins. Deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis, como ácidos e oxidantes. Em caso de derramamento ou exposição, siga os procedimentos de emergência apropriados, como evacuar a área e procurar atendimento médico imediatamente.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Evitar o contato com a pele e os olhos; Use roupas e luvas de proteção; Use apenas em áreas bem ventiladas |
| Identificadores AN | ONU 1564 |
| Código SH | 2816.40.00 |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
| Toxicidade | Tóxico por ingestão, inalação e absorção pela pele; Causa irritação grave na pele e nos olhos; Pode causar irritação do trato respiratório e danos renais |
Métodos para a síntese de hidróxido de bário
O Ba(OH)2 pode ser sintetizado por vários métodos, incluindo a reação do óxido de bário (BaO) com água (H2O) ou a reação do cloreto de bário (BaCl2) com hidróxido de sódio (NaOH).
No primeiro método, o óxido de bário é adicionado lentamente à água destilada com agitação constante até atingir a concentração desejada. A solução resultante é então filtrada e seca para obter a forma sólida de Ba(OH)2.
No segundo método, uma solução de cloreto de bário é adicionada lentamente a uma solução de hidróxido de sódio com agitação constante até atingir o pH desejado. A solução resultante é então filtrada e seca para obter a forma sólida de Ba(OH)2.
Outro método envolve a reação do sulfeto de bário (BaS) com água, produzindo Ba(OH)2 e gás sulfeto de hidrogênio (H2S).
O Ba(OH)2 também pode ser preparado por eletrólise de sais de bário fundidos ou por decomposição térmica de carbonato de bário (BaCO3) em alta temperatura.
No geral, a síntese de Ba(OH)2 requer um manuseio cuidadoso e precauções de segurança adequadas devido às suas propriedades altamente cáusticas e tóxicas. É importante seguir protocolos e regulamentos de segurança adequados ao trabalhar com materiais perigosos.
Usos do hidróxido de bário
O Ba(OH)2 possui diversos usos industriais e laboratoriais devido à sua natureza altamente reativa e propriedades alcalinas. Um de seus principais usos é como reagente químico na produção de diversos produtos químicos, incluindo lubrificantes, plásticos e pesticidas.
O Ba(OH)2 também é usado como estabilizador em PVC e outros plásticos para evitar a descoloração e a degradação causadas pelo calor e pela exposição aos raios UV. Também é utilizado na produção de certos tipos de vidro, como vidro óptico e vidro de alto índice de refração.
No laboratório, o Ba(OH)2 é utilizado como catalisador em diversas reações orgânicas, como reações de esterificação e transesterificação. Também é utilizado como titulante em química analítica para a determinação de ácidos fracos e na preparação de soluções padrão.
Outra aplicação do Ba(OH)2 é a produção de óxido de bário, utilizado na fabricação de tubos de raios catódicos para televisores e monitores de computador.
O Ba(OH)2 também é utilizado no tratamento de águas residuais industriais para remover impurezas e neutralizar efluentes ácidos ou alcalinos antes de serem lançados no meio ambiente.
No geral, o Ba(OH)2 desempenha um papel essencial em muitas indústrias e laboratórios, contribuindo para a produção de muitos produtos e processos.
Questões:
O hidróxido de bário é solúvel?
Sim, o hidróxido de bário é solúvel em água. Quando dissolvido em água, forma uma solução alcalina com pH de aproximadamente 12,5. A solubilidade do Ba(OH)2 em água é relativamente alta, com solubilidade de aproximadamente 3,52 g/100 mL à temperatura ambiente (25 °C). A solubilidade do Ba(OH)2 pode ser afetada por fatores como temperatura, pressão e presença de outras substâncias na solução.
O hidróxido de bário é uma base forte?
Sim, o hidróxido de bário é uma base forte. Quando dissolvido em água, dissocia-se completamente para formar íons bário (Ba2+) e íons hidróxido (OH-) na solução. Esta dissociação produz uma solução altamente alcalina com pH de aproximadamente 12,5. As fortes propriedades básicas do Ba(OH)2 tornam-no um neutralizador eficaz de efluentes ácidos e um catalisador em diversas reações orgânicas.
Qual é a fórmula do hidróxido de bário?
A fórmula do hidróxido de bário é Ba(OH)2. Esta fórmula indica que cada molécula de hidróxido de bário contém um íon bário (Ba2+) e dois íons hidróxido (OH-). O íon bário tem carga +2, enquanto o íon hidróxido tem carga -1. Os dois íons hidróxido em Ba(OH)2 equilibram a carga +2 do íon bário para criar um composto neutro. A fórmula do Ba(OH)2 é importante para a compreensão de suas propriedades e reações, bem como para o cálculo de sua massa molar e outras propriedades físico-químicas.
