O óxido de magnésio (MgO) é um sólido pulverulento branco usado como material de construção e suplemento dietético. Também é utilizado como antiácido devido às suas propriedades básicas (alcalinas).
| Nome IUPAC | Óxido de magnésio |
| Fórmula molecular | MgO |
| Número CAS | 1309-48-4 |
| Sinônimos | Magnésia, Magnesita, Periclásio |
| InChI | InChI=1S/MgO/c1-2 |
Fórmula de Óxido de Magnésio
A fórmula química do óxido de magnésio é MgO. Representa um íon magnésio (Mg2+) e um íon oxigênio (O2-). A fórmula indica a proporção dos elementos presentes no composto e é usada para escrever equações químicas balanceadas para reações envolvendo óxido de magnésio.
Massa molar de óxido de magnésio
A massa molar do óxido de magnésio é 40,304 g/mol. É calculado somando as massas atômicas de cada elemento presente no composto. A massa atômica do magnésio é 24.305 g/mol, enquanto a do oxigênio é 16.000 g/mol. A massa molar é importante na determinação da quantidade de substância presente em uma determinada amostra de óxido de magnésio.
Ponto de ebulição do óxido de magnésio
O ponto de ebulição do óxido de magnésio é 2852°C. A esta temperatura, a pressão de vapor do sólido torna-se igual à pressão atmosférica e ele começa a ferver. O alto ponto de ebulição do óxido de magnésio é devido à sua natureza iônica, que requer uma grande quantidade de energia para separar os íons na estrutura reticular.
Ponto de fusão do óxido de magnésio
O ponto de fusão do óxido de magnésio é 2800°C. A esta temperatura, o sólido muda de estado para líquido. O alto ponto de fusão do óxido de magnésio também se deve à sua natureza iônica e às fortes ligações entre os íons na estrutura da rede.
Densidade de óxido de magnésio g/mL
A densidade do óxido de magnésio é 3,58 g/mL. Este valor pode ser usado para determinar a quantidade de espaço ocupado por uma determinada massa de óxido de magnésio. É uma propriedade característica do composto e é útil em diversas aplicações.
Peso molecular do óxido de magnésio
O peso molecular do óxido de magnésio é 40.304 g/mol. É a soma dos pesos atômicos de cada elemento presente no composto. O peso molecular é importante na determinação da quantidade de substância presente em uma determinada amostra de óxido de magnésio.
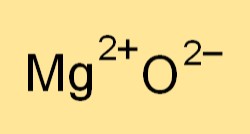
Estrutura do óxido de magnésio
O óxido de magnésio tem uma estrutura cristalina na qual os íons de magnésio são cercados por íons de oxigênio. Os íons de magnésio e oxigênio são mantidos juntos por fortes ligações iônicas, que contribuem para os altos pontos de fusão e ebulição do composto. A estrutura cristalina é um fator importante na determinação das propriedades do óxido de magnésio, como sua densidade e condutividade térmica.
| Aparência | Sólido pulverulento branco |
| Gravidade Específica | 3,58 g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 40,304 g/mol |
| Densidade | 3,58 g/ml |
| Ponto de fusão | 2800°C |
| Ponto de ebulição | 2852°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em ácido |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Alcalino (básico) |
Segurança e perigos do óxido de magnésio
O óxido de magnésio é geralmente considerado seguro para consumo humano nas doses recomendadas e é usado como suplemento dietético e antiácido. No entanto, a inalação de altas concentrações de pó de óxido de magnésio pode causar irritação respiratória e a exposição prolongada pode causar danos aos pulmões. A ingestão de grandes quantidades de óxido de magnésio pode causar diarreia, náuseas e desconforto abdominal. É importante armazenar o óxido de magnésio em local seco e bem ventilado para evitar a inalação de poeira. Evite o contato da pele e dos olhos com o óxido de magnésio, pois isso pode causar irritação. Tal como acontece com todos os produtos químicos, é importante seguir procedimentos adequados de manuseio e segurança ao trabalhar com óxido de magnésio para minimizar o risco de ferimentos.
| Símbolos de perigo | N / D |
| Descrição de segurança | S26-S36/37/39 |
| Números de identificação da ONU | UN3077, Substâncias perigosas para o meio ambiente, sólidas, nos (óxido de magnésio) |
| Código SH | 2825.90.90 |
| Classe de perigo | 9 |
| Grupo de embalagem | III |
| Toxicidade | Baixa toxicidade se ingerido nas doses recomendadas, pode causar irritação respiratória se inalado em altas concentrações |
Métodos de síntese de óxido de magnésio
O óxido de magnésio (MgO) pode ser sintetizado por vários métodos, incluindo decomposição térmica, precipitação e processos sol-gel.
A decomposição térmica, também conhecida como calcinação, envolve o aquecimento de carbonato ou hidróxido de magnésio em altas temperaturas para produzir MgO. Este método é comumente utilizado na produção de materiais refratários, bem como na síntese de MgO de alta pureza para as indústrias farmacêutica e química.
A precipitação é outro método de síntese de MgO. Este método envolve a reação de sais de magnésio, como cloreto ou sulfato de magnésio, com uma solução alcalina, como hidróxido de sódio ou hidróxido de potássio, para formar MgO. O MgO precipitado pode então ser filtrado, lavado e seco para obter um produto puro.
Os processos sol-gel envolvem a hidrólise e condensação de precursores de magnésio, como os alcóxidos de magnésio, para formar MgO. Este método oferece a vantagem de produzir MgO com tamanho de partícula uniforme e estrutura cristalina bem definida, tornando-o útil para aplicações nas indústrias de catalisadores, cerâmica e eletrônica.
No geral, o método para sintetizar MgO dependerá da pureza desejada, tamanho de partícula e estrutura cristalina, bem como da aplicação pretendida do produto MgO. Independentemente do método de síntese, é importante controlar cuidadosamente as condições de reação para evitar a formação de impurezas e obter um produto de MgO de alta qualidade.
Usos do óxido de magnésio
O óxido de magnésio (óxido de magnésio) possui uma ampla gama de aplicações devido à sua estabilidade química, alta condutividade térmica e propriedades de isolamento elétrico. Alguns dos usos mais comuns do óxido de magnésio incluem:
- O óxido de magnésio (MgO) possui uma ampla gama de utilizações devido à sua estabilidade química, alta condutividade térmica e propriedades de isolamento elétrico.
- As indústrias de construção civil utilizam MgO como material resistente ao fogo e na produção de materiais refratários.
- A indústria farmacêutica utiliza MgO como suplemento dietético e antiácido para neutralizar o ácido estomacal.
- O MgO serve como fonte de magnésio na produção de outros compostos de magnésio, como hidróxido de magnésio e carbonato de magnésio.
- A indústria química utiliza o MgO como catalisador em diversas reações, incluindo a produção de borracha sintética, plásticos e resinas.
- As indústrias agrícolas usam MgO como corretivo do solo para melhorar a fertilidade do solo e fornecer magnésio essencial para o crescimento das plantas.
- A capacidade do MgO de adsorver metais pesados e substâncias tóxicas o torna útil para remediação ambiental.
- A indústria cerâmica utiliza o MgO como matéria-prima na produção de cerâmicas, isolantes elétricos, materiais refratários e isolamentos para altas temperaturas.
- A indústria eletrônica utiliza MgO na produção de dispositivos eletrônicos como capacitores e transistores devido à sua alta constante dielétrica e baixa tangente de perdas.
No geral, o óxido de magnésio é um material versátil que tem muitas aplicações devido à sua combinação única de propriedades químicas e físicas.
Questões:
O que melhor descreve um composto como o óxido de magnésio?
O óxido de magnésio (MgO) se forma como um composto iônico.
O magnésio metálico doa elétrons ao oxigênio não metálico, criando íons de magnésio com carga positiva (Mg2+) e íons de óxido com carga negativa (O2-). Esses íons se ligam ionicamente por meio de forte atração eletrostática, resultando em uma estrutura cristalina sólida.
Os compostos iônicos apresentam altos pontos de fusão e ebulição, solidez à temperatura ambiente, boa condutividade elétrica no estado fundido ou dissolvido e insolubilidade na maioria dos solventes. Essas características diferenciam os compostos iônicos dos compostos moleculares, que se formam por ligação covalente e apresentam pontos de fusão e ebulição mais baixos, baixa condutividade elétrica e solubilidade em muitos solventes.
Qual composto iônico é usado como material de construção? sal de calcário óxido de magnésio óxido de ferro
O calcário salino não é um composto iônico, mas o óxido de magnésio e o óxido de ferro são.
O óxido de magnésio (MgO) e o óxido de ferro são usados como materiais de construção. O MgO forma paredes e divisórias à prova de fogo e serve como componente em materiais refratários para aplicações em altas temperaturas. O óxido de ferro, também conhecido como hematita, confere aos tijolos, ao concreto e à cerâmica uma cor marrom-avermelhada como pigmento. A hematita também atua como catalisador em reações químicas e serve como material magnético em diversas tecnologias.
