O ácido sulfúrico (H2SO4) ou óleo de vitríolo é um ácido mineral forte e altamente corrosivo, comumente usado em vários processos industriais, como produção de fertilizantes, refino de petróleo e processamento de metais. É também um poderoso agente desidratante.
| Nome IUPAC | Ácido sulfúrico |
| Fórmula molecular | H2SO4 |
| Número CAS | 7664-93-9 |
| Sinônimos | Óleo de vitríolo, anidrido de ácido sulfúrico, ácido bissulfúrico |
| InChI | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
Propriedades do ácido sulfúrico
Fórmula de Ácido Sulfúrico
A fórmula química do ácido sulfúrico é H2SO4, que representa dois átomos de hidrogênio, um átomo de enxofre e quatro átomos de oxigênio. Esta fórmula representa a composição da molécula de ácido sulfúrico e sua estrutura química.
Massa molar de ácido sulfúrico
A massa molar do ácido sulfúrico é 98,08 g/mol. É calculado somando as massas atômicas de cada elemento da fórmula química do ácido sulfúrico (H2SO4).
Ponto de ebulição do ácido sulfúrico
O ácido sulfúrico tem um ponto de ebulição de 337,1°C. A esta temperatura, a pressão de vapor do líquido atinge a pressão atmosférica e começa a ferver.
Ponto de fusão do ácido sulfúrico
O ponto de fusão do ácido sulfúrico é 10,4°C. É um líquido muito viscoso à temperatura ambiente, mas pode congelar e formar um estado sólido em temperaturas mais baixas.
Densidade de ácido sulfúrico g/ml
A densidade do ácido sulfúrico varia de 1,84 g/mL a 1,93 g/mL, dependendo de sua concentração. À medida que a concentração de ácido sulfúrico aumenta, a sua densidade também aumenta.
Peso molecular do ácido sulfúrico
O peso molecular do ácido sulfúrico é 98,08 g/mol. É calculado somando as massas atômicas de cada elemento em sua fórmula química (H2SO4).
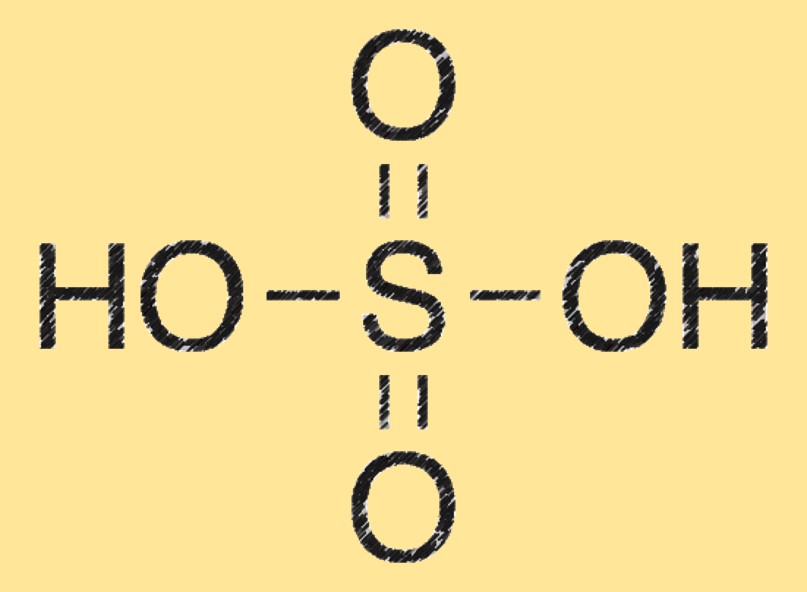
Estrutura do ácido sulfúrico
A molécula de ácido sulfúrico consiste em dois átomos de hidrogênio (H) ligados a um átomo de enxofre (S), também ligado a quatro átomos de oxigênio (O). Possui geometria molecular tetraédrica e é um poderoso agente desidratante.
| Aparência | Líquido límpido, incolor e oleoso |
| Gravidade Específica | 1,84 (água = 1) |
| Cor | Incolor |
| Cheiro | Cheiro pungente e sulfuroso |
| Massa molar | 98,079 g/mol |
| Densidade | 1.835g/mL |
| Ponto de fusão | 10,5ºC |
| Ponto de ebulição | 337ºC |
| Ponto flash | 140°F (60°C) |
| Solubilidade em Água | Completamente miscível |
| Solubilidade | Solúvel em água e álcool |
| Pressão de vapor | 40mmHg (20°C) |
| Densidade do vapor | 2,5 (ar = 1) |
| pKa | -3 |
| pH | Menos de 1 (fortemente ácido) |
Segurança e perigos do ácido sulfúrico
O ácido sulfúrico é uma substância altamente corrosiva e perigosa. O contato com a pele e os olhos pode causar queimaduras graves e cegueira. A inalação de seus vapores pode irritar o sistema respiratório e causar tosse, respiração ofegante e falta de ar. É inflamável e reativo e deve ser manuseado com cautela em área bem ventilada, utilizando equipamentos de proteção como luvas e proteção para os olhos. Os derramamentos devem ser limpos imediatamente para evitar danificar as superfícies e potencialmente prejudicar as pessoas. O armazenamento e a rotulagem adequados são necessários para garantir o manuseio seguro.
| Símbolos de perigo | Corrosivo, Irritante, Nocivo |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Proibido fumar. Armazene em uma área bem ventilada. Mantenha o recipiente bem fechado. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. |
| Números de identificação da ONU | ONU1830 |
| Código SH | 2815.11.00 |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
| Toxicidade | Oral: LD50 = 1,2 g/kg (Rato) |
Métodos para a síntese de ácido sulfúrico
O H2SO4 pode ser sintetizado por vários métodos, incluindo o processo de contato e o processo de câmara mestre.
O processo de contato é o método mais utilizado para a produção industrial de ácido sulfúrico, que envolve a oxidação do dióxido de enxofre em trióxido de enxofre e depois a reação do trióxido de enxofre com água para produzir H2SO4.
O processo da câmara de chumbo, por outro lado, envolve a oxidação do dióxido de enxofre com dióxido de nitrogênio na presença de um catalisador, geralmente dióxido de chumbo, e então a reação do trióxido de enxofre resultante com água. Ambos os métodos produzem H2SO4 com diferentes níveis de pureza e concentração, que pode ser ainda mais purificado e concentrado conforme necessário.
Usos do ácido sulfúrico
H2SO4 é um produto químico versátil e amplamente utilizado em diversas indústrias. As pessoas costumam usar ácido sulfúrico na produção de fertilizantes, detergentes, corantes e pigmentos. Também desempenha um papel no refino de produtos petrolíferos, no processamento de minerais e minérios e na produção de produtos químicos como ácido nítrico e sulfatos. Os laboratórios utilizam H2SO4 como reagente e serve como catalisador em reações químicas. As baterias de chumbo-ácido usam ácido sulfúrico como eletrólito, e as siderúrgicas o utilizam para decapagem para remover ferrugem e incrustações antes do revestimento ou pintura.
No geral, o H2SO4 desempenha um papel crucial em muitos processos industriais, tornando-o um dos produtos químicos mais importantes do mundo.
Questões:
O ácido sulfúrico é um ácido forte?
Sim, H2SO4 é um ácido forte. Um ácido forte é aquele que se dissocia completamente em água para produzir íons de hidrogênio (H+), o que significa que doa todos os seus íons de hidrogênio para a solução. Considerado um dos ácidos mais fortes, o ácido sulfúrico possui alto nível de acidez, o que o torna muito reativo e corrosivo. Para evitar danos às pessoas e ao meio ambiente, é essencial o manuseio e armazenamento adequados do ácido sulfúrico.
Para que é usado o ácido sulfúrico?
O ácido sulfúrico é amplamente utilizado em diversas indústrias e aplicações. Alguns dos usos mais comuns do H2SO4 incluem:
- Produção de fertilizantes: O ácido sulfúrico é utilizado na produção de ácido fosfórico, que é um componente chave de muitos fertilizantes.
- Refino de petróleo: O ácido sulfúrico é usado para remover impurezas, como compostos de enxofre, do petróleo bruto durante o processo de refino.
- Processamento de metais: O ácido sulfúrico é usado no processamento de metais para remover ferrugem e incrustações de ferro e aço, bem como para refinar minérios metálicos.
- Fabricação: O ácido sulfúrico é usado na produção de uma variedade de produtos, incluindo detergentes, corantes, pigmentos e outros produtos químicos.
- Baterias automotivas: O ácido sulfúrico é usado como eletrólito em baterias de chumbo-ácido, comumente usadas em carros e outros veículos.
- Reagente de laboratório: O ácido sulfúrico é comumente usado como reagente de laboratório devido ao seu alto nível de reatividade e capacidade de dissolver muitas substâncias.
Que tipo de ácido é o ácido sulfúrico?
H2SO4 é um ácido inorgânico forte. Classificado como ácido diprótico, o H2SO4 doa dois íons de hidrogênio (H+) a uma solução, tornando-o um ácido mineral forte. Devido à sua natureza altamente reativa e corrosiva, deve-se ter cuidado ao manusear e armazenar o H2SO4 para evitar danos às pessoas e ao meio ambiente. As indústrias utilizam amplamente o ácido sulfúrico em seus processos, inclusive na produção de fertilizantes, detergentes, corantes, pigmentos e outros produtos químicos, bem como no refino de produtos petrolíferos e no processamento de minérios metálicos.
Qual é a fórmula do ácido sulfúrico?
A fórmula química do ácido sulfúrico é H2SO4.
O que é óleo de vitríolo?
Óleo de vitríolo é outro termo para ácido sulfúrico, um produto químico poderoso e altamente corrosivo. É comumente utilizado na produção de fertilizantes, detergentes e corantes, bem como no refino de petróleo e processamento de outros produtos químicos.
