O íon carbonato, CO32-, é um íon carregado negativamente composto por um átomo de carbono, três átomos de oxigênio e uma carga geral de -2. É comumente encontrado em minerais como calcita e dolomita, bem como em soluções aquosas como bicarbonato. Desempenha um papel crucial no controle dos níveis de pH no oceano e em outros corpos d’água.
| Nome IUPAC | Íon Carbonato |
| Fórmula molecular | CO32- |
| Número CAS | 497-19-8 |
| Sinônimos | Ácido carbônico, trióxido de carbono |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Propriedades dos íons carbonato
Fórmula de Carbonato
A fórmula para o íon carbonato é representada por CO3 ^ 2-, onde C representa carbono, O representa oxigênio e o símbolo 2- representa a carga negativa do íon. Esta fórmula indica que existem três átomos de oxigênio e um átomo de carbono no íon carbonato, conferindo-lhe sua estrutura molecular característica.
Carga de carbonato de CO3
O íon carbonato, CO3^2-, possui carga negativa 2 devido à presença de três átomos de oxigênio e um átomo de carbono em sua fórmula química. A carga negativa resulta da presença de elétrons extras no íon carbonato, tornando-o um íon com carga negativa.
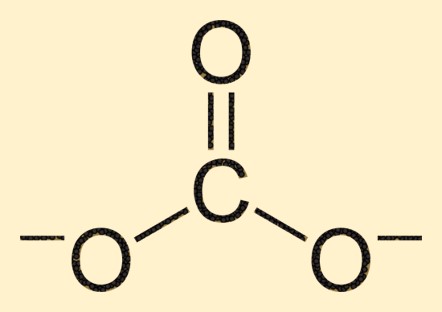
Estrutura carbonática
O íon carbonato é composto por um átomo de carbono em seu centro, rodeado por três átomos de oxigênio em um arranjo trigonal planar. O átomo de carbono forma uma ligação dupla com um átomo de oxigênio, enquanto os outros dois átomos de oxigênio estão ligados ao átomo de carbono por meio de ligações simples. Esta estrutura confere ao íon CO3 2- sua forma e propriedades características.
Peso molecular do íon carbonato
O peso molecular do íon carbonato é de aproximadamente 60,01 g/mol, calculado com base nos pesos atômicos de seus elementos constituintes (carbono, oxigênio). O peso molecular do ácido carbônico é importante na determinação da quantidade de ácido carbônico em uma amostra, bem como na determinação de suas propriedades físicas e químicas.
| Aparência | Pó branco sólido |
| Gravidade Específica | 2,5 |
| Cor | Branco |
| Cheiro | Nenhum |
| Massa molar | 100,09 g/mol |
| Densidade | 2,83g/cm3 |
| Ponto de fusão | 825°C |
| Ponto de ebulição | 1484°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel em água |
| Solubilidade | Solúvel em ácidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| PKa | 10h33 |
| PH | 8.6 |
Segurança e perigos dos íons carbonato
O íon carbonato, CO32-, é amplamente utilizado em diversas indústrias, mas deve ser manuseado com cautela. A inalação de altos níveis de pó de carbonato pode causar problemas respiratórios, enquanto a ingestão em grandes quantidades pode causar problemas digestivos. O contato com a pele pode causar irritação e lesões cutâneas. Também é inflamável e pode reagir com outros produtos químicos para produzir gases perigosos. É importante seguir medidas de segurança, como usar equipamentos de proteção individual e armazenar íons carbonato em recipientes apropriados, para minimizar o risco de acidentes.
| Símbolo de perigo | Nenhum |
| Descrição de segurança | Não é considerado perigoso e não está associado a nenhum símbolo de perigo específico. |
| UM ID | N / D |
| Código SH | N / D |
| Classe de perigo | N / D |
| Grupo de embalagem | N / D |
| Toxicidade | Não tóxico |
Métodos de síntese de íons carbonato
Os íons carbonato (CO3 2- ) podem ser sintetizados por vários métodos diferentes. O método mais comum de produção de íons CO3 2- é pela reação de dióxido de carbono e água. Esta reação produz uma solução de ácido carbônico, que pode então ser neutralizada com um álcali, como o hidróxido de sódio, para produzir ácido carbônico. O ácido carbônico também pode ser produzido por eletrólise de uma solução salina, onde íons carbonato se formam no cátodo. Esses íons também podem ser produzidos em laboratório por uma reação química entre um ácido e um sal carbonato.
Usos de íons carbonato
As indústrias utilizam amplamente o ácido carbônico para diversos fins. Fabricantes de fermento em pó, produtores de antiácidos e empresas de bebidas geralmente incorporam ácido carbônico em seus produtos. A indústria de tratamento de água controla os níveis de pH em água potável e piscinas usando íons carbonato. A indústria da construção utiliza íons CO3 2- como principal componente do cimento para fazer concreto. Os agricultores adicionam íons carbonato ao solo para melhorar sua alcalinidade e promover o crescimento das culturas. A indústria química utiliza íons carbonato como catalisador e reagente em diversas reações químicas. A indústria alimentícia preserva os alimentos incorporando íons carbonato. Devido à sua versatilidade, os íons carbonato desempenham um papel essencial em muitos produtos de uso diário e processos industriais.
