O íon acetato (C2H3O2-) é um ânion composto por um átomo de carbono, dois átomos de hidrogênio e um átomo de oxigênio, amplamente presente na química orgânica e na bioquímica.
| Nome IUPAC | Etanoato |
| Fórmula molecular | C2H3O2- |
| Número CAS | 127-09-3 |
| Sinônimos | Anião ácido acético; Anião ácido etanóico; Ânion acetato |
| InChI | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
Enchimento de acetato
O íon acetato é um ânion, o que significa que carrega uma carga negativa. O íon acetato é derivado do ácido acético , que é um ácido orgânico fraco que se dissocia em água para formar íons hidrogênio (H+) e íons acetato (C2H3O2-). O íon acetato tem carga -1 e é um íon comum em sistemas biológicos e em muitas reações químicas.
Fórmula de acetato
O íon acetato tem a fórmula química C2H3O2-. É um íon carregado negativamente composto por dois átomos de carbono, três átomos de hidrogênio e dois átomos de oxigênio. O íon acetato é a base conjugada do ácido acético , que possui a fórmula química CH3COOH. O íon acetato forma sais com íons carregados positivamente, como sódio (Na+) e cálcio (Ca2+) para produzir acetato de sódio (CH3COO-Na+) e acetato de cálcio (CH3COO-Ca2+), respectivamente. ).
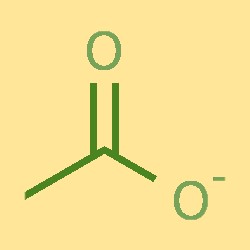
Estrutura dos íons acetato
O íon acetato consiste em um átomo de carbono, dois átomos de hidrogênio e um átomo de oxigênio. O átomo de carbono está ligado a um átomo de oxigênio e dois átomos de hidrogênio, formando uma estrutura COH. O átomo de oxigênio também está ligado a um íon carregado negativamente. O íon acetato tem formato trigonal planar, com ângulos de ligação de aproximadamente 120°.
Massa molar de íon acetato
A massa molar do íon acetato (C2H3O2) é 59,04 g/mol. É calculado somando os pesos atômicos de todos os átomos do íon. A massa molar é importante para determinar a quantidade de substância presente em uma amostra.
Ponto de ebulição dos íons acetato
O ponto de ebulição do íon acetato não é aplicável porque é um íon carregado negativamente e não existe como uma molécula independente. No entanto, o ponto de ebulição do ácido acético, que contém o íon acetato, é 118,1°C.
Peso molecular do íon acetato
O peso molecular do íon acetato (C2H3O2) é 59,04 g/mol, que é a soma dos pesos atômicos de todos os átomos do íon. O peso molecular é útil para determinar a quantidade de substância em uma amostra.
| Aparência | Não aplicável (íon) |
| Gravidade Específica | Não aplicável (íon) |
| Cor | Não aplicável (íon) |
| Cheiro | Não aplicável (íon) |
| Massa molar | 59,04 g/mol |
| Densidade | Não aplicável (íon) |
| Ponto de fusão | Não aplicável (íon) |
| Ponto de ebulição | Não aplicável (íon) |
| Ponto flash | Não aplicável (íon) |
| Solubilidade em Água | Solúvel em água |
| Solubilidade | Solúvel em água e solventes polares |
| Pressão de vapor | Não aplicável (íon) |
| Densidade do vapor | Não aplicável (íon) |
| pKa | 4,76 |
| pH | Ácido |
Segurança e perigos dos íons acetato
O íon acetato é geralmente considerado seguro porque é um íon que ocorre naturalmente em muitos produtos alimentícios e bebidas. Porém, soluções concentradas de ácido acético , que contêm o íon acetato, podem ser prejudiciais se ingeridas, inaladas ou em contato com a pele e os olhos, causando irritação ou queimaduras químicas. Equipamento de proteção e ventilação adequados devem ser usados ao manusear soluções concentradas de ácido acético.
| Símbolos de perigo | Irritante |
| Descrição de segurança | S2 – Manter fora do alcance das crianças. S26 – Em caso de contato com os olhos, lavar imediatamente com água em abundância e consultar um médico. S37 – Usar luvas adequadas. S60 – Este material e seu recipiente devem ser descartados como resíduos perigosos. |
| Números de identificação da ONU | UN2790 |
| Código SH | 2915.90.90 |
| Classe de perigo | 8 |
| Grupo de embalagem | III |
| Toxicidade | O íon acetato é considerado levemente tóxico quando ingerido, mas soluções concentradas de ácido acético (que contêm íons acetato) podem ser prejudiciais se ingeridas, inaladas ou em contato com a pele e os olhos. |
Métodos de síntese de íons acetato
A síntese do íon acetato geralmente envolve a formação de ácido acético , que é o composto original que contém o íon acetato. Um método comum de síntese de ácido acético envolve a oxidação do etanol usando um agente oxidante como o ácido crômico. Outro método envolve a carbonilação do metanol utilizando monóxido de carbono e um catalisador. O ácido acético também pode ser produzido biologicamente pela fermentação de carboidratos por bactérias acetogênicas. O íon acetato também pode ser obtido pela dissociação do ácido acético em uma solução, que libera o íon acetato e os íons hidrogênio. Em alguns casos, o íon acetato também pode ser obtido pela reação de um éster acético com uma base forte.
Usos de íons acetato
O íon acetato (C2H3O2), na forma de ácido acético , atende a diversos propósitos em todos os setores. A indústria alimentícia utiliza ácido acético como condimento e conservante devido ao seu sabor ácido e propriedades antimicrobianas. A indústria têxtil utiliza ácido acético como componente de amaciantes e como fixador de corantes. Na indústria química, o ácido acético serve como matéria-prima para a produção de outros produtos químicos como o acetato de vinila, utilizado em adesivos e revestimentos. A indústria farmacêutica utiliza íons acetato como ingrediente em medicamentos e como tampão em tratamentos médicos. Além disso, o acetato de celulose, um tipo de plástico, é produzido a partir do ácido acético e tem aplicação em filmes e fibras ópticas.
