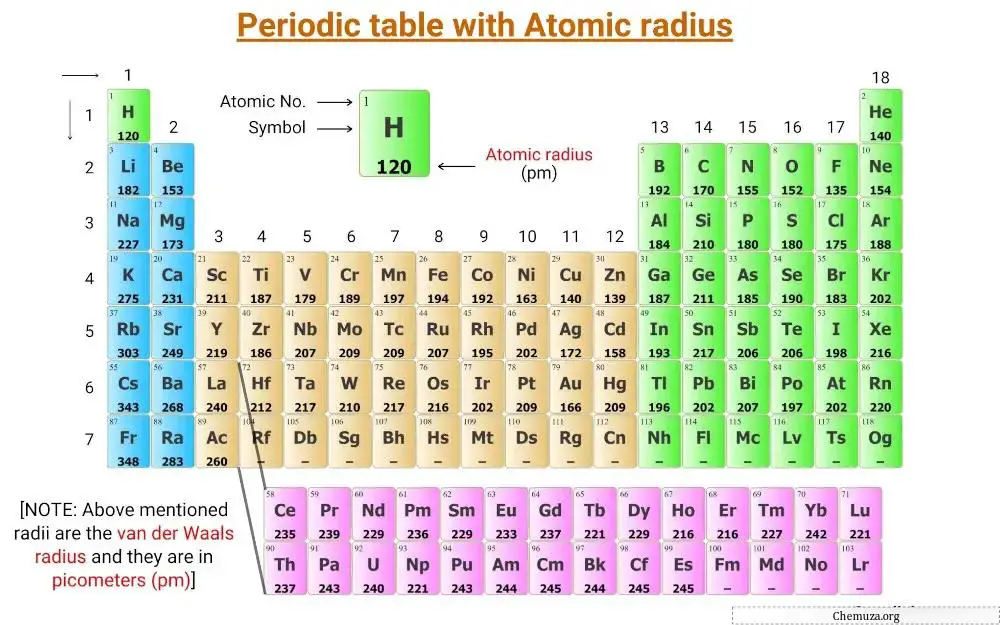
Esta é uma tabela periódica com os valores dos raios atômicos dos elementos rotulados nela.
Os raios mencionados na tabela periódica acima são o raio de van der Waals e estão em picômetros (pm).
Bem, existem algumas coisas conceituais importantes sobre o raio atômico dos elementos que você deve saber.
Então, vamos direto ao assunto.
Qual é o raio atômico?
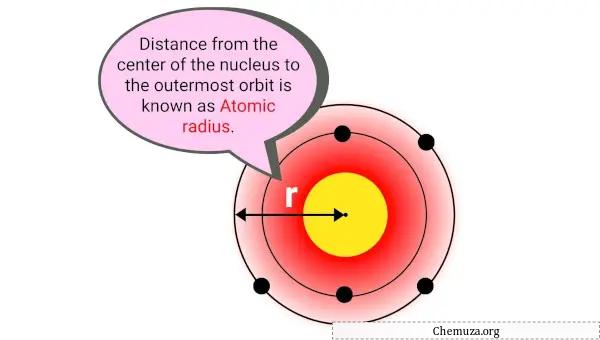
O raio atômico é a distância entre o centro do núcleo de um átomo e o elétron mais externo em sua nuvem eletrônica.
Em termos mais simples, é do tamanho de um átomo. O raio atômico é geralmente medido em picômetros (pm), ou um trilionésimo de metro.
Os átomos são extremamente pequenos e difíceis de visualizar, mas o conceito de raio atômico nos ajuda a entender como os átomos interagem entre si e como se comportam em diferentes reações químicas.
O tamanho de um átomo pode afetar suas propriedades químicas , como a forma como ele se liga a outros átomos ou moléculas .
Como medimos o raio atômico?
O raio atômico é geralmente medido usando vários métodos experimentais, como cristalografia de raios X, difração de elétrons e espectroscopia.
Esses métodos envolvem o estudo do comportamento dos átomos quando eles interagem com certas formas de energia, como raios X ou elétrons.
- Na cristalografia de raios X , um feixe de raios X é direcionado a um cristal do elemento que está sendo estudado. Os raios X difratam os átomos no cristal e o padrão de difração resultante pode ser usado para determinar a distância entre os átomos e, portanto, seus raios.
- Na difração de elétrons , um feixe de elétrons é direcionado para uma película fina do elemento que está sendo estudado. À medida que os elétrons passam pelo filme, eles espalham os átomos, criando um padrão de difração que pode ser analisado para determinar o raio atômico.
- A espectroscopia envolve o estudo das interações entre luz e matéria. Ao analisar os comprimentos de onda da luz absorvida ou emitida por um átomo, os cientistas podem determinar seu raio atômico.
Fatores que afetam o raio atômico
O tamanho de um átomo é influenciado por vários fatores, incluindo:
- Carga nuclear
- Configuração eletronica
- Distância dos elétrons de valência do núcleo, etc.
Carga nuclear
O número de prótons no núcleo de um átomo é chamado de número atômico. [1]
À medida que o número atômico aumenta, o número de prótons no núcleo aumenta, resultando em uma carga nuclear maior.
Essa carga aumentada atrai elétrons com mais força em direção ao núcleo, resultando em um raio atômico menor.
Configuração eletronica
A forma como os elétrons estão dispostos em torno do núcleo de um átomo determina sua configuração eletrônica. [2]
Quanto mais próximos os elétrons estiverem do núcleo, menor será o raio atômico.
Átomos com maior número de elétrons em seu nível de energia mais externo (camada de valência) terão um raio atômico maior, porque os elétrons estão mais distantes e menos fortemente atraídos pelo núcleo.
Distância dos elétrons de valência do núcleo
A distância entre os elétrons de valência e o núcleo também afeta o raio atômico.
À medida que o número de camadas eletrônicas aumenta, os elétrons de valência se afastam do núcleo, resultando em um aumento no raio atômico.
É importante notar que os fatores que afetam o raio atômico estão inter-relacionados. Por exemplo, enquanto um aumento na carga nuclear resultará num raio atômico menor, um aumento no número de elétrons no nível de energia mais externo (camada de valência) resultará em um raio atômico maior. Portanto, o tamanho total de um átomo resulta de um equilíbrio entre esses fatores.
Para obter mais informações, você deve ler as tendências do raio atômico na tabela periódica.
Resumo
O raio atômico é o tamanho de um átomo, medido em picômetros, desde o centro do núcleo até o elétron mais externo da nuvem eletrônica.
Isso nos ajuda a entender como os átomos interagem e afetam suas propriedades químicas. Métodos experimentais, como cristalografia de raios X, difração de elétrons e espectroscopia, são usados para medir o raio atômico.
Os fatores que afetam o raio atômico são a carga nuclear, a configuração eletrônica e a distância entre os elétrons de valência e o núcleo. Esses fatores estão inter-relacionados e determinam o tamanho geral de um átomo.
