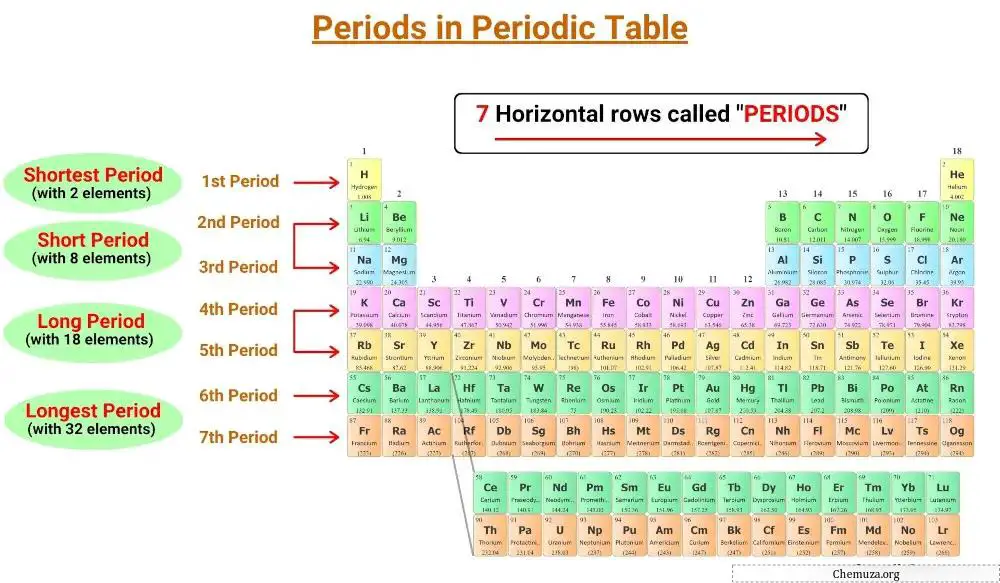
As linhas horizontais da tabela periódica são chamadas de períodos e existem 7 períodos na tabela periódica.
Elementos localizados no mesmo período possuem o mesmo número de camadas eletrônicas.
Vamos explorar mais os períodos da tabela periódica.
O que são períodos na tabela periódica?
Na tabela periódica, os pontos são as linhas que se estendem horizontalmente da esquerda para a direita.
A tabela periódica é organizada de forma que os elementos com propriedades semelhantes sejam agrupados em colunas chamadas grupos ou famílias, enquanto os elementos do mesmo período possuem o mesmo número de camadas eletrônicas.
Existem sete períodos na tabela periódica, numerados de 1 a 7. [1]
Número de camadas de um elemento e seu número de período
O número de camadas de um elemento determina seu período na tabela periódica.
Por exemplo, os elementos do período 1 possuem apenas uma camada eletrônica, enquanto os elementos do período 2 possuem duas camadas eletrônicas e assim por diante.
Esta organização ajuda os químicos a prever as propriedades de um elemento com base na sua localização na tabela periódica.
Características dos elementos nos períodos
À medida que avançamos num período da tabela periódica, diversas características dos elementos mudam de maneira previsível. Isto se deve às tendências periódicas observadas nas propriedades dos elementos.
Raio atômico:
À medida que você se move da esquerda para a direita durante um período, o raio atômico geralmente diminui. [2]
Isso ocorre porque o número de prótons no núcleo aumenta, causando uma atração maior entre o núcleo e os elétrons no nível de energia mais externo. Isso resulta em um raio atômico menor.
Eletro-negatividade:
A eletronegatividade é a medida da capacidade de um átomo de atrair elétrons para si em uma ligação química.
À medida que você se move da esquerda para a direita durante um período, a eletronegatividade geralmente aumenta. [3]
Isso ocorre porque o raio atômico é menor e a carga positiva do núcleo é mais forte, tornando-o mais atraente para os elétrons carregados negativamente.
Energia de ionização:
Energia de ionização é a quantidade de energia necessária para remover um elétron de um átomo.
À medida que você se move da esquerda para a direita durante um período, a energia de ionização geralmente aumenta. [4]
Isso ocorre porque o raio atômico é menor e os elétrons são presos com mais força pelo núcleo, tornando mais difícil a remoção de um elétron.
Outras características:
Pontos de fusão e ebulição: Geralmente aumentam da esquerda para a direita durante um período, mas com algumas exceções.
Caráter metálico: diminui da esquerda para a direita ao longo de um período, à medida que os não metais se tornam mais predominantes.
Reatividade: Os elementos tornam-se menos reativos à medida que você se move da esquerda para a direita durante um período, porque os elétrons são mantidos com mais força e têm menos probabilidade de participar de reações químicas.
Importância dos períodos em química
Os períodos da tabela periódica são essenciais para a compreensão do comportamento dos elementos porque fornecem informações sobre a configuração eletrônica dos elementos e como eles interagem com outros elementos. Aqui estão algumas razões pelas quais os períodos são importantes na química:
- Prever Propriedades: A tabela periódica permite aos cientistas prever as propriedades dos elementos com base na sua posição na tabela. Por exemplo, elementos do mesmo período têm o mesmo número de camadas eletrônicas, o que pode ajudar a prever seu tamanho atômico, reatividade e outras propriedades.
- Identificar tendências: A disposição dos elementos na tabela periódica permite aos cientistas identificar tendências nas suas propriedades. Por exemplo, a eletronegatividade e a energia de ionização tendem a aumentar da esquerda para a direita durante um período, enquanto o tamanho atômico tende a diminuir. Esta informação pode ser usada para fazer previsões sobre como os elementos se comportam nas reações químicas.
- Agrupamento de Elementos: A tabela periódica agrupa os elementos em categorias com base em suas propriedades, como metais, não metais e metalóides . Isso ajuda os cientistas a compreender as semelhanças e diferenças entre os elementos e como eles interagem entre si.
- Descobrindo novos elementos: A tabela periódica também ajuda os cientistas a prever a existência e as propriedades de novos elementos. Ao examinar as lacunas na tabela, os cientistas podem prever as propriedades de elementos não descobertos e pesquisá-los em laboratório.
Resumo
A tabela periódica possui sete linhas horizontais chamadas períodos. Elementos do mesmo período possuem o mesmo número de camadas eletrônicas. Existem sete períodos na tabela periódica, numerados de 1 a 7, e o número de camadas de um elemento determina seu período.
À medida que se passa por um período da tabela periódica, o raio atômico geralmente diminui, enquanto a eletronegatividade e a energia de ionização geralmente aumentam. Outras características, como pontos de fusão e ebulição, caráter metálico e reatividade também mudam previsivelmente ao longo do tempo.
Os períodos da tabela periódica são importantes para prever as propriedades dos elementos, identificar tendências, agrupar elementos e descobrir novos elementos. Ao examinar as lacunas na tabela, os cientistas podem prever as propriedades de elementos não descobertos e pesquisá-los em laboratório.
