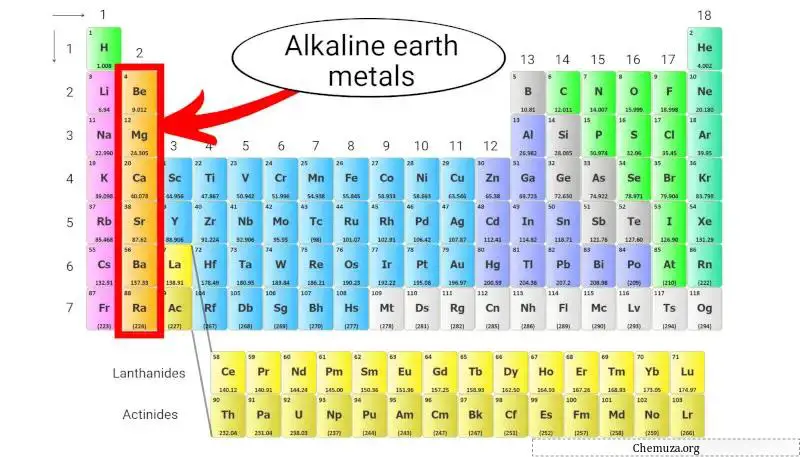
Os metais alcalino-terrosos são um grupo de elementos localizados na segunda coluna da tabela periódica . Eles incluem berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra).
Esses metais possuem dois elétrons em sua camada mais externa, [1] o que os torna quimicamente reativos, mas não tão reativos quanto os metais alcalinos , que estão na primeira coluna.
Vamos explorar mais sobre os metais alcalino-terrosos da tabela periódica.
O que são metais alcalino-terrosos?

Os metais alcalino-terrosos fazem parte do grupo 2 da tabela periódica e possuem duas características particulares.
- Quando reagem com a água, produzem hidróxidos de natureza alcalina ou básica.
- Seus minerais óxidos (BeO, magnesita, MgO, berilo, etc.) são encontrados principalmente na crosta terrestre e são estáveis ao calor.
Explicação
Quando os metais alcalino-terrosos (Mg, Ca, Sr, Ba e Ra) reagem com a água, formam hidróxidos de natureza alcalina (ou básica). [2]
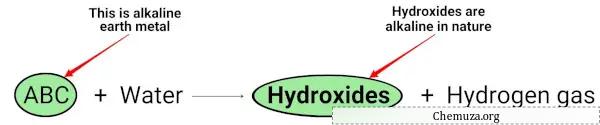
Você pode ver na equação química acima que os metais alcalinos fornecem hidróxidos de natureza básica (com pH> 7) e liberam gás hidrogênio.
Por exemplo:
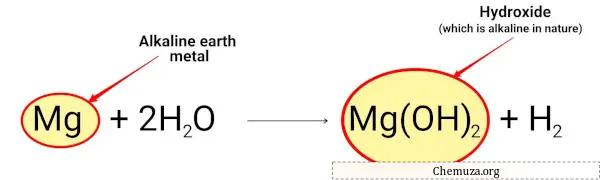
O magnésio reage com a água e forma hidróxido de magnésio, que é de natureza alcalina.
Além disso, esses metais são encontrados principalmente na crosta terrestre (como óxidos) e esses minerais oxidados são estáveis ao calor. [2]
Estes dois critérios dão a estes metais o nome de “metais alcalino-terrosos”.
(Nota: É importante notar que o berílio, que também é um elemento do Grupo 2, não forma uma solução alcalina quando reage com a água. Em vez disso, seus hidróxidos apresentam comportamento anfotérico, o que significa que podem se comportar como um ácido ou uma base Portanto, o berílio não é considerado um metal alcalino-terroso, embora pertença ao mesmo grupo.)
O que é comum a todos os metais alcalino-terrosos?
Os metais alcalino-terrosos compartilham várias características comuns.
Por exemplo, ambos têm dois elétrons de valência em seu nível de energia mais externo, o que os torna bastante reativos.
Essa reatividade se deve à tendência de perder esses elétrons durante as reações químicas, resultando na formação de cátions com carga +2.
Além disso, todos os metais alcalino-terrosos têm uma aparência branco-prateada brilhante.

Então essas são as duas principais coisas que os metais alcalino-terrosos têm em comum.
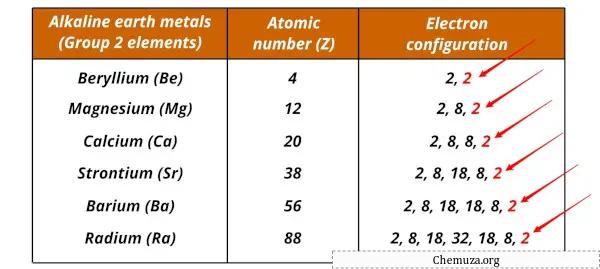
Lista de metais alcalinos e suas configurações eletrônicas
Os metais alcalino-terrosos e suas configurações eletrônicas são mostrados abaixo.
| Elemento | Configuração eletronica |
| Berílio (Ser) | [Ele] 2s 2 |
| Magnésio (Mg) | [Faça] 3s 2 |
| Cálcio (Ca) | [Ar] 4s 2 |
| Estrôncio (Sr) | [Kr] 5s 2 |
| Bário (Ba) | [Xe] 6s 2 |
| Rádio (Ra) | [Rn] 7s 2 |
Tendências Periódicas em Metais Alcalinos Terrosos
À medida que descemos no grupo dos metais alcalino-terrosos da tabela periódica, as seguintes tendências podem ser observadas:
- Valência: Todos os metais alcalino-terrosos têm a mesma valência de +2. Portanto, não há mudança na valência à medida que descemos no grupo.
- Tamanho atômico: O tamanho atômico dos metais alcalino-terrosos aumenta à medida que descemos no grupo. Isso ocorre porque o número de camadas eletrônicas (ou órbitas ) aumenta e o efeito de blindagem dos elétrons internos reduz a atração entre o núcleo e os elétrons mais externos.
- Caráter Metálico: O caráter metálico dos metais alcalino-terrosos aumenta à medida que descemos no grupo. Isso ocorre porque os átomos se tornam maiores e contêm mais elétrons, tornando-os mais facilmente capazes de perder elétrons e formar íons positivos.
- Eletronegatividade: A eletronegatividade dos metais alcalino-terrosos diminui à medida que descemos no grupo. Isso ocorre porque os átomos se tornam maiores e têm mais camadas de elétrons, tornando mais difícil atrair elétrons para eles.
- Afinidade Eletrônica: A afinidade eletrônica dos metais alcalino-terrosos é geralmente baixa e diminui à medida que se avança no grupo.
- Energia de Ionização: A energia de ionização dos metais alcalino-terrosos diminui à medida que descemos no grupo. Isso ocorre porque átomos maiores têm mais camadas eletrônicas e os elétrons mais externos estão mais distantes do núcleo, tornando-os mais fáceis de remover.
Resumo
Os metais alcalino-terrosos incluem berílio, magnésio, cálcio, estrôncio, bário e rádio. Eles têm dois elétrons em sua camada mais externa, o que os torna reativos, mas menos que os metais alcalinos.
Esses metais produzem hidróxidos alcalinos quando reagem com a água e contêm minerais oxidados estáveis ao calor. As principais características comuns a todos os metais alcalino-terrosos são possuir dois elétrons de valência, ser branco prateado e brilhante, e formar cátions com carga +2.
A valência permanece a mesma à medida que descemos no grupo, mas o tamanho atômico e o caráter metálico aumentam, enquanto a eletronegatividade, a afinidade eletrônica e a energia de ionização diminuem.
