
Então você já viu a imagem acima, certo?
Deixe-me explicar brevemente a imagem acima.
A estrutura de Lewis do SbCl3 possui um átomo de antimônio (Sb) no centro que é cercado por três átomos de cloro (Cl). Existem 3 ligações simples entre o átomo de antimônio (Sb) e cada átomo de cloro (Cl). Há 1 par solitário no átomo de antimônio (Sb) e 3 pares solitários nos três átomos de cloro (Cl).
Se você não entendeu nada da imagem acima da estrutura de Lewis de SbCl3, fique comigo e você obterá uma explicação detalhada passo a passo sobre como desenhar uma estrutura de Lewis de SbCl3 .
Então, vamos prosseguir para as etapas de desenho da estrutura de Lewis do SbCl3.
Etapas para desenhar a estrutura de Lewis do SbCl3
Etapa 1: Encontre o número total de elétrons de valência na molécula SbCl3
Para encontrar o número total de elétrons de valência na molécula de SbCl3 , primeiro você precisa conhecer os elétrons de valência presentes no átomo de antimônio e também no átomo de cloro.
(Elétrons de valência são os elétrons presentes na órbita mais externa de qualquer átomo.)
Aqui vou lhe dizer como encontrar facilmente os elétrons de valência do antimônio e também do cloro usando uma tabela periódica.
Elétrons totais de valência na molécula SbCl3
→ Elétrons de valência dados pelo átomo de antimônio:
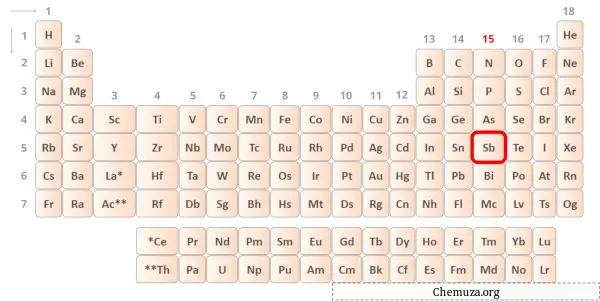
O antimônio é um elemento do grupo 15 da tabela periódica. [1] Portanto, os elétrons de valência presentes no antimônio são 5 .
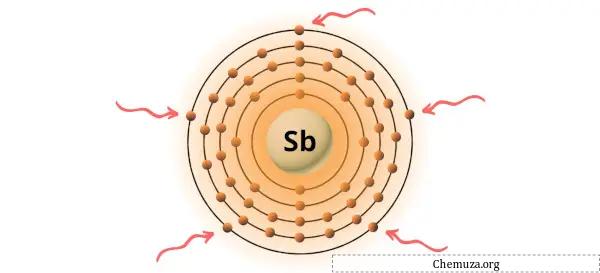
Você pode ver os 5 elétrons de valência presentes no átomo de antimônio, conforme mostrado na imagem acima.
→ Elétrons de valência dados pelo átomo de cloro:

O cloro é um elemento do grupo 17 da tabela periódica. [2] Portanto, os elétrons de valência presentes no cloro são 7 .
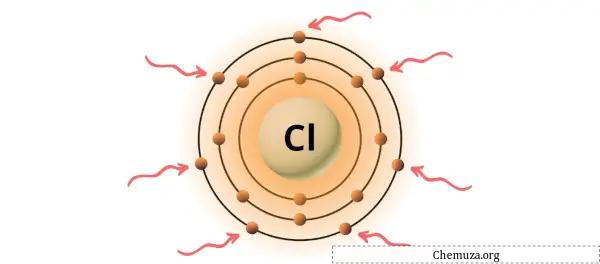
Você pode ver os 7 elétrons de valência presentes no átomo de cloro, conforme mostrado na imagem acima.
Então,
Total de elétrons de valência na molécula SbCl3 = elétrons de valência doados por 1 átomo de antimônio + elétrons de valência doados por 3 átomos de cloro = 5 + 7(3) = 26 .
Passo 2: Selecione o átomo central
Para selecionar o átomo central, devemos lembrar que o átomo menos eletronegativo permanece no centro.
Agora, aqui a molécula dada é SbCl3 (tricloreto de antimônio) e contém átomos de antimônio (Sb) e átomos de cloro (Cl).
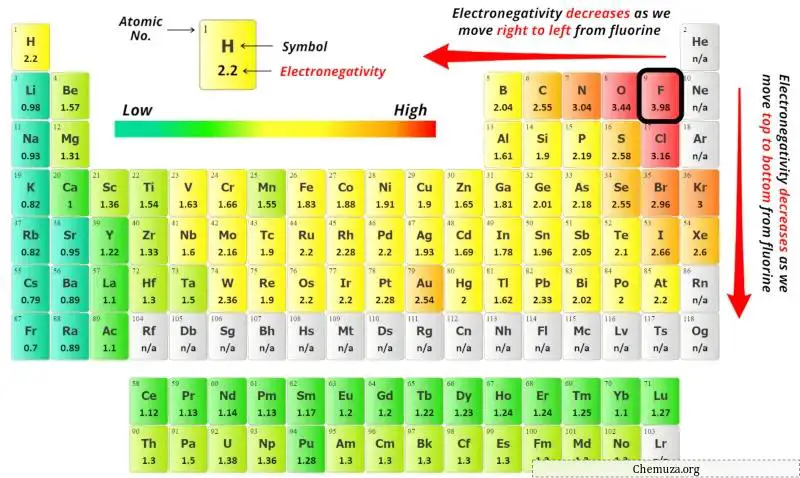
Você pode ver os valores de eletronegatividade do átomo de antimônio (Sb) e do átomo de cloro (Cl) na tabela periódica acima.
Se compararmos os valores de eletronegatividade do antimônio (Sb) e do cloro (Cl), então o átomo de antimônio é menos eletronegativo .
Aqui, o átomo de antimônio (Sb) é o átomo central e os átomos de cloro (Cl) são os átomos externos.
Etapa 3: Conecte cada átomo colocando um par de elétrons entre eles
Agora na molécula de SbCl3 devemos colocar os pares de elétrons entre o átomo de antimônio (Sb) e os átomos de cloro (Cl).
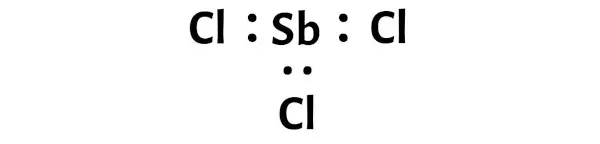
Isto indica que o antimônio (Sb) e o cloro (Cl) estão quimicamente ligados entre si em uma molécula de SbCl3.
Etapa 4: torne os átomos externos estáveis. Coloque o par de elétrons de valência restante no átomo central.
Nesta etapa você precisa verificar a estabilidade dos átomos externos.
Aqui no esboço da molécula SbCl3 você pode ver que os átomos externos são átomos de cloro.
Esses átomos externos de cloro formam um octeto e, portanto, são estáveis.
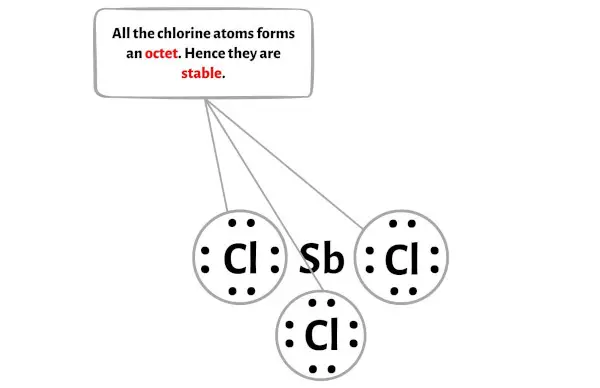
Além disso, na etapa 1, calculamos o número total de elétrons de valência presentes na molécula de SbCl3.
A molécula SbCl3 tem um total de 26 elétrons de valência e destes, apenas 24 elétrons de valência são usados no diagrama acima.
Portanto, o número de elétrons restantes = 26 – 24 = 2 .
Você precisa colocar esses 2 elétrons no átomo central de antimônio no diagrama acima da molécula SbCl3.
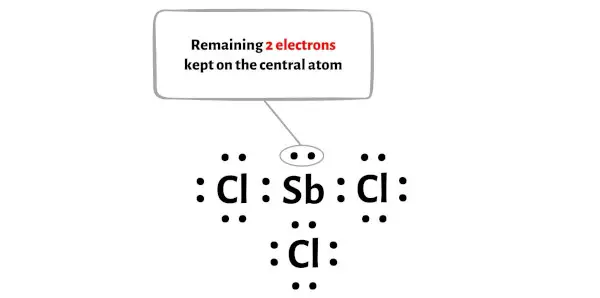
Agora vamos passar para a próxima etapa.
Etapa 5: verifique o octeto no átomo central
Nesta etapa, é necessário verificar se o átomo central do antimônio (Sb) é estável ou não.
Para verificar a estabilidade do átomo central de antimônio (Sb), é necessário verificar se ele forma um octeto ou não.
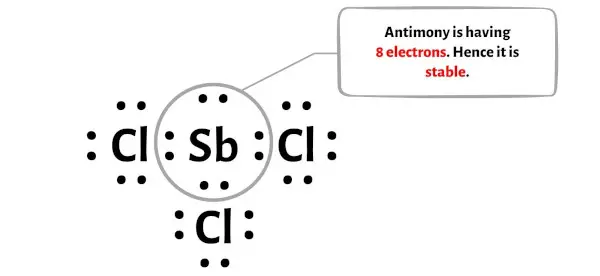
Você pode ver na imagem acima que o átomo de antimônio forma um octeto. Isso significa que tem 8 elétrons.
E assim o átomo central de antimônio é estável.
Agora vamos para a última etapa para verificar se a estrutura de Lewis do SbCl3 é estável ou não.
Passo 6: Verifique a estabilidade da estrutura de Lewis
Agora você chegou à última etapa em que precisa verificar a estabilidade da estrutura de Lewis do SbCl3.
A estabilidade da estrutura de Lewis pode ser verificada usando um conceito formal de carga .
Resumindo, devemos agora encontrar a carga formal dos átomos de antimônio (Sb), bem como dos átomos de cloro (Cl) presentes na molécula de SbCl3.
Para calcular o imposto formal, deve-se utilizar a seguinte fórmula:
Carga formal = Elétrons de valência – (Elétrons ligantes)/2 – Elétrons não ligantes
Você pode ver o número de elétrons ligantes e elétrons não ligantes para cada átomo da molécula SbCl3 na imagem abaixo.
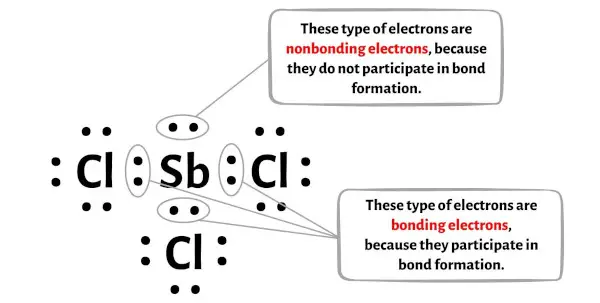
Para o átomo de antimônio (Sb):
Elétrons de valência = 5 (porque o antimônio está no grupo 15)
Elétrons de ligação = 6
Elétrons não ligantes = 2
Para o átomo de cloro (Cl):
Elétrons de valência = 7 (porque o cloro está no grupo 17)
Elétrons de ligação = 2
Elétrons não ligantes = 6
| Acusação formal | = | elétrons de valência | – | (Elétrons de ligação)/2 | – | Elétrons não ligantes | ||
| Sb | = | 5 | – | 6/2 | – | 2 | = | 0 |
| Cl | = | 7 | – | 2/2 | – | 6 | = | 0 |
A partir dos cálculos de carga formal acima, você pode ver que o átomo de antimônio (Sb), bem como o átomo de cloro (Cl), têm carga formal “zero” .
Isto indica que a estrutura de Lewis do SbCl3 acima é estável e não há mais alterações na estrutura do SbCl3 acima.
Na estrutura de pontos de Lewis de SbCl3 acima, você também pode representar cada par de elétrons de ligação (:) como uma ligação simples (|). Fazer isso resultará na seguinte estrutura de Lewis de SbCl3.
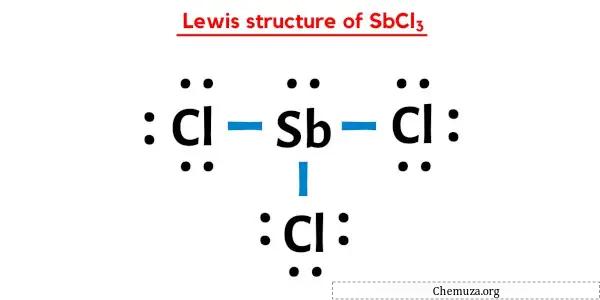
Espero que você tenha entendido completamente todas as etapas acima.
Para mais prática e melhor compreensão, você pode tentar outras estruturas de Lewis listadas abaixo.
Experimente (ou pelo menos veja) estas estruturas de Lewis para uma melhor compreensão:
