O sulfeto de níquel (NiS) é um composto de níquel e enxofre. É utilizado em diversas indústrias, incluindo cerâmica e vidro, devido às suas propriedades e aplicações únicas.
| Nome IUPAC | Sulfeto de níquel |
| Fórmula molecular | NiS |
| Número CAS | 16812-54-7 |
| Sinônimos | Sulfeto de níquel (II), monossulfeto de níquel, sulfeto de níquel |
| InChI | InChI=1S/Ni.S/q+2;-2 |
Propriedades do sulfeto de níquel
Fórmula de Sulfeto de Níquel
A fórmula química do monossulfeto de níquel é NiS. Consiste em um átomo de níquel (Ni) e um átomo de enxofre (S), indicando uma proporção de um para um entre os dois elementos.
Massa molar de sulfeto de níquel
A massa molar do monossulfeto de níquel (NiS) é de aproximadamente 90,76 gramas por mol (g/mol). Este valor é calculado somando as massas atômicas de um átomo de níquel e um átomo de enxofre.
Ponto de ebulição do sulfeto de níquel
O sulfeto de níquel não possui ponto de ebulição bem definido, pois tende a se decompor antes de atingir seu ponto de ebulição devido às suas propriedades químicas. No entanto, esta decomposição pode ocorrer em altas temperaturas.
Ponto de fusão de sulfeto de níquel
O ponto de fusão do monossulfeto de níquel é de aproximadamente 797 graus Celsius (1.467 graus Fahrenheit). Esta temperatura representa o ponto em que o monossulfeto de níquel sólido muda para o estado líquido.
Densidade de sulfeto de níquel g/mL
A densidade do monossulfeto de níquel é de aproximadamente 5,9 gramas por centímetro cúbico (g/cm³). Este valor de densidade indica a massa de monossulfeto de níquel por unidade de volume e é relativamente alto devido ao arranjo compacto de seus átomos.
Peso molecular do sulfeto de níquel
O peso molecular do monossulfeto de níquel (NiS) é de aproximadamente 90,76 g/mol. Este valor é determinado somando os pesos atômicos de níquel e enxofre presentes no composto.
Estrutura do sulfeto de níquel
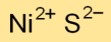
O monossulfeto de níquel pode adotar várias estruturas cristalinas, incluindo arranjos hexagonais e cúbicos. Essas estruturas afetam suas propriedades físicas e químicas, tornando-o útil em diversas aplicações como semicondutores e catalisadores.
Solubilidade do sulfeto de níquel
O monossulfeto de níquel tem solubilidade limitada em água e em muitos outros solventes. Sua solubilidade depende de fatores como temperatura, pH e presença de outros íons. Geralmente, é considerado insolúvel em soluções aquosas. No entanto, pode reagir com ácidos para formar sais solúveis de níquel.
| Aparência | Preto sólido |
| Gravidade Específica | 5,9g/cm³ |
| Cor | Preto |
| Cheiro | Inodoro |
| Massa molar | 90,76 g/mol |
| Densidade | 5,9g/cm³ |
| Ponto de fusão | 797°C (1467°F) |
| Ponto de ebulição | Decompõe-se em altas temperaturas |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solubilidade limitada |
| Solubilidade | Insolúvel em água, reage com ácidos para formar sais solúveis de níquel |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Neutro |
Segurança e perigos do sulfeto de níquel
O monossulfeto de níquel apresenta riscos potenciais à segurança. A inalação ou ingestão do pó pode causar irritação respiratória e desconforto digestivo. O contato com a pele pode causar irritação ou dermatite, principalmente em indivíduos sensíveis. A exposição prolongada a níveis elevados pode causar problemas respiratórios mais graves. A queima ou decomposição libera vapores tóxicos, exigindo ventilação adequada e equipamento de proteção. O manuseio seguro envolve o uso de luvas, óculos de segurança e jaleco. Evite o contato com os olhos, pele e roupas. Se exposto, lave as áreas afetadas com água e procure atendimento médico se os sintomas persistirem. Siga sempre as instruções de segurança e trabalhe em áreas bem ventiladas.
| Símbolos de perigo | Irritante, Perigo para a saúde |
| Descrição de segurança | Manuseie com cuidado. Utilize equipamento de proteção adequado. Evite contato com a pele, olhos e inalação de poeira. Trabalhe em áreas bem ventiladas. |
| Números de identificação da ONU | Não aplicável |
| Código SH | Não aplicável |
| Classe de perigo | Risco ambiental (N) |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Pode causar irritação; a exposição prolongada a níveis elevados pode causar problemas respiratórios mais graves. |
Métodos de síntese de sulfeto de níquel
O monossulfeto de níquel pode ser sintetizado por vários métodos. Uma abordagem comum envolve a reação entre um sal de Ni solúvel, tal como NiCl2 ou Ni(NO3)2 , e uma fonte de sulfeto solúvel, tal como sulfeto de sódio ou sulfeto de hidrogênio gasoso. Este método de precipitação produz monossulfeto de níquel sólido como produto.
Outro método é a decomposição térmica de compostos de níquel na presença de fontes de enxofre. Por exemplo, o aquecimento de sais de níquel como carbonato de níquel ou hidróxido de níquel com enxofre em altas temperaturas pode produzir monossulfeto de níquel.
A deposição química de vapor (CVD) é usada para a deposição de filmes finos de monossulfeto de níquel. Neste método, precursores gasosos de níquel e enxofre são introduzidos em um ambiente controlado, onde reagem para formar uma fina camada de monossulfeto de níquel sobre um substrato.
A síntese hidrotérmica envolve a reação de soluções aquosas de sais de níquel e compostos de enxofre em alta temperatura e pressão. Este método permite a formação controlada de nanopartículas de monossulfeto de níquel.
No geral, esses métodos oferecem diversas maneiras de sintetizar monossulfeto de níquel, atendendo a diferentes aplicações e requisitos em indústrias como eletrônica, catálise e ciência de materiais.
Usos do sulfeto de níquel
O monossulfeto de níquel encontra aplicações versáteis em todos os setores devido às suas propriedades únicas. Alguns usos principais incluem:
- Catalisadores: Serve como catalisador em diversas reações químicas, incluindo processos de hidrogenação e dessulfurização na indústria do petróleo.
- Semicondutores: Os fabricantes usam monossulfeto de níquel para criar semicondutores, especialmente em células solares de película fina, onde serve como um componente essencial na camada absorvedora.
- Vidro e cerâmica: O monossulfeto de níquel realça a cor e a opacidade do vidro e da cerâmica, desempenhando um papel crucial na produção de objetos decorativos e funcionais.
- Materiais Termoelétricos: Pesquisadores estão estudando o monossulfeto de níquel por suas propriedades termoelétricas, com o objetivo de explorar sua capacidade de converter diferenciais de calor em energia elétrica em dispositivos termoelétricos.
- Eletrodos: As baterias recarregáveis se beneficiam do monossulfeto de níquel, pois funciona como um material de eletrodo devido à sua excepcional condutividade elétrica e estabilidade.
- Sensores de gás: Os materiais de monossulfeto de níquel desempenham um papel fundamental nos sensores de gás, permitindo a detecção de gases como hidrogênio, amônia e dióxido de enxofre.
- Medicina: Em várias aplicações médicas, o monossulfeto de níquel em nanoescala é usado para sistemas de administração de medicamentos e tratamento de câncer.
- Vidro Sulfurado: Contribui para a formação de vidros sulfurados com propriedades ópticas únicas, adequados para óptica infravermelha.
- Células de combustível: Nanopartículas de monossulfeto de níquel estão sendo investigadas para aplicações potenciais em células de combustível devido às suas propriedades eletrocatalíticas.
- Resistência à corrosão: Quando adicionado aos metais, melhora suas propriedades de resistência à corrosão.
A adaptabilidade do monossulfeto de níquel em diferentes setores mostra seu valor na contribuição para avanços em materiais, eletrônica, energia e muito mais.
Questões:
P: Qual é a fórmula do sulfeto de níquel (ii)?
R: A fórmula do monossulfeto de níquel (II) é NiS.
P: O sulfeto de níquel é solúvel?
R: O monossulfeto de níquel é geralmente insolúvel em água.
P: O sulfeto de níquel ii é solúvel em água?
R: Não, o monossulfeto de níquel (II) é insolúvel em água.
P: O sulfeto de níquel (ii) é solúvel ou insolúvel?
R: O monossulfeto de níquel (II) é insolúvel em água.
P: Ocorre uma reação quando soluções aquosas de cloreto de níquel (ii) e sulfeto de sódio são combinadas?
R: Sim, ocorre uma reação, formando monossulfeto de níquel (II) como um precipitado sólido.
P: Qual é a solubilidade molar do sulfeto de níquel (ii) em 0,053 m kcn?
R: A solubilidade molar do monossulfeto de níquel (II) em 0,053 M KCN é calculada com base em constantes de equilíbrio específicas.
P: Qual é o resultado de uma reação entre nitrato de níquel (iii) e sulfeto de rubídio?
R: Uma reação entre nitrato de níquel (III) e sulfeto de rubídio resulta na formação de produtos determinados por suas respectivas propriedades químicas.
P: Como escrever uma fórmula quando o sulfeto de níquel (ii) é encontrado?
R: A fórmula do monossulfeto de níquel (II) é NiS.
