O carbonato de níquel (NiCO3) é formado a partir de íons de níquel e íons carbonato. É um sólido verde utilizado em cerâmicas e catalisadores devido às suas propriedades únicas.
| Nome IUPAC | Carbonato de níquel (II) |
| Fórmula molecular | NiCO3 |
| Número CAS | 3333-67-3 |
| Sinônimos | Carbonato de níquel; Ácido carbônico, sal de níquel, monocarbonato de níquel |
| InChI | InChI=1S/CH2O3.Ni/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Propriedades do carbonato de níquel
Fórmula de Carbonato de Níquel
A fórmula química do monocarbonato de níquel é NiCO3. Consiste em um átomo de níquel (Ni), um átomo de carbono (C) e três átomos de oxigênio (O).
Massa molar de carbonato de níquel
A massa molar do monocarbonato de níquel (NiCO3) é de aproximadamente 118,7 gramas por mol. Este valor é obtido somando as massas atômicas de seus elementos constituintes.
Ponto de ebulição do carbonato de níquel
O monocarbonato de níquel não possui um ponto de ebulição distinto porque tende a se decompor antes de atingir o ponto de ebulição. Quando aquecido, decompõe-se em óxido de níquel, dióxido de carbono e oxigênio.
Ponto de fusão do carbonato de níquel
O monocarbonato de níquel tem um ponto de fusão de aproximadamente 200°C (392°F). Nessa temperatura, ele passa do estado sólido para o líquido.
Densidade de carbonato de níquel g/mL
A densidade do monocarbonato de níquel é de aproximadamente 3,6 gramas por centímetro cúbico (g/cm³). Este valor de densidade indica a massa do composto por unidade de volume.
Peso molecular do carbonato de níquel
O peso molecular do monocarbonato de níquel (NiCO3) é de aproximadamente 118,7 gramas por mol. É calculado somando os pesos atômicos de seus átomos constituintes.
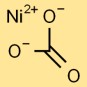
Estrutura do carbonato de níquel
O monocarbonato de níquel tem uma estrutura básica na qual um átomo central de níquel está ligado a três átomos de oxigênio em um arranjo triangular. Isso forma o núcleo do íon carbonato. A estrutura é mantida unida por ligações iônicas e covalentes.
Solubilidade do carbonato de níquel
O monocarbonato de níquel é pouco solúvel em água. Sua solubilidade aumenta à medida que o pH da solução diminui. Também pode dissolver-se em soluções ácidas contendo substâncias como ácido clorídrico.
As propriedades do monocarbonato de níquel o tornam útil em diversas aplicações. Sua insolubilidade em água o torna adequado para aplicações em cerâmicas e pigmentos. Sua decomposição em altas temperaturas contribui para sua utilização em processos catalíticos.
| Aparência | Verde sólido |
| Gravidade Específica | 3,6g/cm³ |
| Cor | Verde |
| Cheiro | Inodoro |
| Massa molar | 118,7 g/mol |
| Densidade | 3,6g/cm³ |
| Ponto de fusão | 200°C (392°F) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Pouco solúvel |
| Solubilidade | Solúvel em ácidos como ácido clorídrico |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do carbonato de níquel
O monocarbonato de níquel apresenta riscos potenciais à segurança. Pode irritar a pele e os olhos ao contato, causando vermelhidão e desconforto. A inalação de poeira ou vapores pode causar irritação do trato respiratório ou tosse. É aconselhável manuseá-lo com cuidado, utilizando equipamentos de proteção adequados como luvas e óculos. Evite ingerir ou inalar o composto. Se exposto, lave as áreas afetadas e procure atendimento médico se os sintomas persistirem. Medidas adequadas de ventilação e contenção são essenciais para minimizar os riscos. Seguir os protocolos de segurança ao trabalhar com monocarbonato de níquel é crucial para prevenir possíveis problemas de saúde e garantir um ambiente seguro.
| Símbolos de perigo | Irritante, Perigo para a saúde |
| Descrição de segurança | Irritante; Evite contato e inalação; Manuseie com cuidado |
| Números de identificação da ONU | Não atribuído |
| Código SH | 2836.40.00 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não classificado |
| Toxicidade | Pode causar irritação na pele e nos olhos; irritação respiratória se inalado |
Métodos de síntese de carbonato de níquel
O monocarbonato de níquel pode ser sintetizado por vários métodos. Uma abordagem comum envolve a reação entre um sal solúvel de níquel (como cloreto de níquel ou sulfato de níquel ) e um sal carbonato solúvel (como carbonato de sódio) em água. As duas soluções são misturadas, levando à formação de monocarbonato de níquel insolúvel na forma de precipitado verde. Este precipitado é então filtrado, lavado e seco para obter o produto final.
Outro método envolve a reação entre óxido de níquel ou hidróxido de níquel e gás dióxido de carbono na presença de umidade. Isto resulta na formação de monocarbonato de níquel com água. Este processo é frequentemente usado industrialmente para produzir monocarbonato de níquel.
Além disso, um processo de precipitação pode ser utilizado misturando uma solução de um sal solúvel de níquel com uma solução de um sal solúvel de carbonato. A mistura resultante é agitada e o precipitado de monocarbonato de níquel formado é recolhido e tratado.
Esses métodos de síntese produzem monocarbonato de níquel para diversas aplicações, como cerâmicas, catalisadores e pigmentos. O controle cuidadoso das condições de reação e das etapas de purificação é crucial para obter produtos de monocarbonato de níquel de alta qualidade.
Usos do carbonato de níquel
O monocarbonato de níquel encontra diversas aplicações devido às suas propriedades únicas. Alguns usos importantes incluem:
- Produção de Cerâmica e Vidro: O monocarbonato de níquel realça a cerâmica e o vidro com cores vibrantes para expressão artística e uso industrial.
- Catalisador: Serve como catalisador ou precursor de catalisador em diversos processos químicos, facilitando reações de oxidação através da liberação de oxigênio durante a decomposição em altas temperaturas.
- Galvanoplastia: O uso de monocarbonato de níquel como precursor permite a galvanoplastia de níquel em diversas superfícies, melhorando assim a aparência da superfície e a resistência à corrosão.
- Indústria de Baterias: Nas tecnologias de baterias, especialmente aquelas baseadas em níquel, contribui para os materiais catódicos, apoiando assim o avanço dos sistemas de baterias.
- Pigmentos e tintas: O monocarbonato de níquel é essencial na produção de um espectro de tons verdes em pigmentos, tintas e tintas.
- Agricultura: Sua aplicação como fonte de nutriente níquel em fertilizantes beneficia o crescimento das plantas e é utilizado na agricultura.
- Medicina: Embora raro, os investigadores estão a explorar potenciais aplicações médicas devido a certos compostos de níquel, nomeadamente o monocarbonato de níquel, que demonstram propriedades antimicrobianas.
- Fotografia: Historicamente, encontrou um papel nos toners fotográficos em preto e branco, enriquecendo tons e contrastes.
- Têxteis: A indústria têxtil utiliza monocarbonato de níquel para melhorar a absorção de corantes e infundir cor nos tecidos.
- Pesquisa e Educação: Os atributos químicos do monocarbonato de níquel estabelecem sua importância em laboratórios de química para demonstrações educacionais, experimentos e pesquisas.
Essas aplicações versáteis demonstram a importância do monocarbonato de níquel em diversas indústrias, desde a melhoria da estética da cerâmica até o desempenho de tecnologias avançadas, como baterias e catalisadores.
Questões:
P: Qual elemento é o mais reativo?
R: Sódio.
P: Que material útil é feito misturando ferro com cromo, carbono e níquel?
R: Aço inoxidável.
P: O carbonato de níquel é solúvel em água?
R: Não é muito solúvel.
P: Quantos moles de carbono existem no níquel tetracarbonil?
R: Quatro moles.
P: Como remover o revestimento de níquel do aço carbono?
R: Usando agentes de remoção químicos apropriados ou métodos eletroquímicos.
P: Equação iônica líquida de nitrato de níquel (II) e carbonato de sódio?
A: Ni²⁺ + CO₃²⁻ → NiCO₃(s).
P: Papel do monóxido de carbono na extração de níquel?
R: Atua como agente redutor para extrair níquel de seus minérios.
P: Solubilidade do monocarbonato de níquel?
R: Baixa solubilidade em água.
P: Números atômicos de carbono, sódio e níquel?
A: Carbono: 6, Sódio: 11, Níquel: 28.
P: O que acontece quando você mistura carbonato de amônio, cloreto de níquel e água?
A: Formação de precipitado de monocarbonato de níquel e liberação de gás cloreto de amônio.
