O sulfeto de zinco (ZnS) é um composto composto de zinco e enxofre. É usado em diversas aplicações, incluindo materiais luminescentes, optoeletrônica e fósforos para telas LED.
| Nome IUPAC | Sulfeto de zinco |
| Fórmula molecular | ZnS |
| Número CAS | 1314-98-3 |
| Sinônimos | Esfalerita, Blende, Zinc Blende, Wurtzita |
| InChI | InChI=1S/S.Zn |
Propriedades do sulfeto de zinco
Fórmula de Sulfeto de Zinco
A fórmula química do sulfeto de zinco é ZnS, indicando sua composição de átomos de zinco (Zn) e enxofre (S). Este composto constitui uma parte crucial de diversas aplicações industriais e científicas devido às suas propriedades únicas.
Massa molar de sulfeto de zinco
O sulfeto de zinco tem massa molar de aproximadamente 97,45 gramas por mol. Este valor representa as massas atômicas combinadas dos átomos constituintes de zinco e enxofre em uma única molécula de ZnS.
Ponto de ebulição do sulfeto de zinco
O sulfeto de zinco não tem um ponto de ebulição distinto porque tende a se decompor em vez de sofrer um verdadeiro processo de ebulição quando aquecido. Essa característica resulta de suas propriedades químicas.
Ponto de fusão do sulfeto de zinco
O sulfeto de zinco tem um ponto de fusão de cerca de 1.850 graus Celsius (3.362 graus Fahrenheit). Este alto ponto de fusão o torna adequado para diversas aplicações em altas temperaturas.
Densidade de sulfeto de zinco g/mL
A densidade do sulfeto de zinco varia dependendo de sua forma cristalina. Geralmente, sua densidade fica entre 3,98 e 4,09 gramas por centímetro cúbico (g/cm³). Essa faixa de densidade contribui para seu uso em materiais ópticos.
Peso molecular de sulfeto de zinco
O peso molecular do sulfeto de zinco, calculado pela soma das massas atômicas de seus componentes, é de aproximadamente 97,45 gramas por mol. Este valor é crucial para determinar a quantidade de ZnS em uma determinada amostra.
Estrutura do sulfeto de zinco
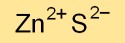
O sulfeto de zinco existe em diferentes estruturas cristalinas, principalmente como blenda cúbica de zinco (também conhecida como esfalerita) e wurtzita hexagonal. Esses arranjos de átomos determinam suas propriedades físicas e ópticas.
Solubilidade do sulfeto de zinco
O sulfeto de zinco é pouco solúvel em água, tornando-o praticamente insolúvel. Esta característica se deve às fortes ligações entre os átomos de zinco e enxofre, resultando em dissolução limitada em soluções aquosas. No entanto, pode ser dissolvido em certos ácidos ou álcalis sob condições específicas.
| Aparência | Sólido |
| Gravidade Específica | 3,98 – 4,09g/cm³ |
| Cor | Branco, amarelo, marrom, preto |
| Cheiro | Inodoro |
| Massa molar | ~97,45 g/mol |
| Densidade | 3,98 – 4,09g/cm³ |
| Ponto de fusão | ~1850°C (~3362°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Praticamente insolúvel |
| Solubilidade | Solúvel em ácidos e álcalis sob condições específicas |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | ~4,7 |
| pH | ~7 (neutro) |
Segurança e perigos do sulfeto de zinco
O sulfeto de zinco tem baixa toxicidade aguda, mas pode liberar dióxido de enxofre tóxico quando aquecido. Geralmente é considerado seguro em condições normais de manuseio. No entanto, a inalação de poeiras ou vapores pode causar irritação respiratória. Evitar o contato com a pele e os olhos. Em caso de exposição, enxaguar abundantemente e consultar um médico se a irritação persistir. Fogo ou calor excessivo podem causar decomposição e liberar gases perigosos. Armazene longe de materiais incompatíveis. Manuseie com cuidado, use equipamento de proteção adequado e trabalhe em áreas bem ventiladas para garantir a segurança e prevenir riscos potenciais associados ao sulfeto de zinco.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Baixa toxicidade aguda; libera gás tóxico dióxido de enxofre quando aquecido; manuseie com cuidado |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2830.90.10 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade; irritação respiratória causada por poeira ou vapores; manuseie com cuidado |
Métodos de síntese de sulfeto de zinco
O sulfeto de zinco pode ser sintetizado por vários métodos. Uma abordagem comum é reagir com gases de óxido de zinco (ZnO) e sulfeto de hidrogênio (H2S) em temperaturas elevadas. A reação prossegue da seguinte forma:
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
Outro método envolve a reação entre cloreto de zinco (ZnCl2) e gás sulfídrico:
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
Alternativamente, nanopartículas de sulfeto de zinco podem ser sintetizadas utilizando métodos de precipitação. Isto envolve a mistura de sais solúveis de zinco com sais solúveis de sulfeto sob condições controladas, levando à formação de nanopartículas de sulfeto de zinco. Em alguns casos, compostos orgânicos são usados como agentes de proteção para controlar o tamanho e a estabilidade das partículas.
O sulfeto de zinco também pode ser preparado pela reação do zinco metálico com enxofre elementar. As duas substâncias são aquecidas juntas para iniciar a reação:
Zn(s) + S(s) → ZnS(s)
Esses métodos proporcionam versatilidade na produção de sulfeto de zinco com propriedades variadas para diferentes aplicações, como optoeletrônica, materiais luminescentes, etc.
Usos do sulfeto de zinco
O sulfeto de zinco encontra diversas aplicações em diversas indústrias devido às suas propriedades únicas. Aqui estão seus usos notáveis:
- Revestimentos Ópticos: A transparência do sulfeto de zinco na região infravermelha o torna um material valioso para revestimentos ópticos, lentes e janelas em sistemas e sensores de imagem térmica.
- Materiais luminescentes: Serve como material hospedeiro para criar compostos luminescentes, como sulfeto de zinco dopado com cobre para aplicações que brilham no escuro.
- Aplicações de semicondutores: Em transistores de película fina e outros dispositivos semicondutores, os filmes de sulfeto de zinco desempenham um papel nos componentes eletrônicos.
- Fósforos de display LED: Os displays LED usam fósforos de sulfeto de zinco para melhorar a cor e o brilho.
- Detecção de raios X e raios gama: Os detectores de cintilação usam as propriedades cintilantes do sulfeto de zinco para detectar raios X e raios gama.
- Pigmentos e tintas: Os pigmentos brancos em tintas, revestimentos e tintas de impressão utilizam formas específicas de sulfeto de zinco, como branco de zinco ou litopone.
- Marcadores fluorescentes: Em aplicações biológicas, os pesquisadores funcionalizam nanopartículas de sulfeto de zinco para marcadores fluorescentes em estudos de imagem.
- Células solares: Os cientistas estão estudando nanopartículas de sulfeto de zinco para determinar seu potencial para melhorar a absorção de luz em células solares fotovoltaicas.
- Catálise: Explorando sua natureza semicondutora, os pesquisadores estão estudando as propriedades catalíticas do sulfeto de zinco em diversas reações químicas.
- Janelas infravermelhas: Dispositivos ópticos como câmeras, telescópios e sensores que incorporam sulfeto de zinco para janelas infravermelhas.
A versatilidade do sulfeto de zinco surge de sua capacidade de exibir luminescência, transparência e comportamento semicondutor. Suas aplicações personalizadas contribuem significativamente para áreas como óptica, eletrônica, energia e ciência dos materiais.
Questões:
P: Qual é a fórmula do sulfeto de zinco?
R: A fórmula do sulfeto de zinco é ZnS.
P: O sulfeto de zinco é solúvel?
R: O sulfeto de zinco é geralmente insolúvel em água.
P: O ZnS é solúvel em água?
R: Não, o ZnS não é solúvel em água.
Q: O sulfeto de zinco contém 67,1% de zinco em massa. Qual é a fração mássica de enxofre no sulfeto de zinco?
R: A fração mássica de enxofre no sulfeto de zinco é de 32,9%.
P: Como você poderia separar o cloreto de zinco do sulfeto de zinco?
R: O cloreto de zinco e o sulfeto de zinco podem ser separados dissolvendo o cloreto de zinco em água, deixando para trás o sulfeto de zinco insolúvel.
P: O sulfeto de zinco é iônico?
R: Sim, o sulfeto de zinco é principalmente iônico.
P: Que tipo de defeito estequiométrico é representado pelo ZnS?
R: O sulfeto de zinco pode apresentar defeitos estequiométricos do tipo Frenkel.
P: O que é ZnS?
R: ZnS é a fórmula química do sulfeto de zinco, um composto de zinco e enxofre.
P: Qual é o pH mínimo necessário para evitar a precipitação de ZnS?
R: O pH mínimo necessário para evitar a precipitação de ZnS é de aproximadamente 4,7.
Q: Esta imagem mostra a célula unitária cúbica para ZnS. Quantos íons Zn²⁺ existem nesta célula cúbica?
R: Na célula cúbica de ZnS, existem quatro íons Zn²⁺.
P: O ZnS é iônico ou covalente?
R: O ZnS é considerado principalmente iônico.
P: Que tipo de reação é Zn + S = ZnS?
R: A reação Zn + S = ZnS é uma reação de síntese ou combinação.
