O iodeto de cobre (CuI) é um composto químico amarelo brilhante. Forma-se quando o cobre reage com o iodo e é usado em diversas aplicações, incluindo síntese orgânica e catálise.
| Nome IUPAC | Iodeto de cobre (I) |
| Fórmula molecular | CuI |
| Número CAS | 7681-65-4 |
| Sinônimos | Iodeto cuproso, monoiodeto de cobre, iodeto cuproso (1:1) |
| InChI | InChI=1S/Cu.HI/h;1H/q+1;/p-1 |
Propriedades do iodeto de cobre
Fórmula de Iodeto de Cobre
A fórmula química do iodeto cuproso é CuI. Isto indica que cada unidade de iodeto cuproso consiste em um átomo de cobre (Cu) e um átomo de iodo (I). Esta fórmula simples representa a estequiometria do composto.
Massa molar de iodeto de cobre
A massa molar do iodeto cuproso (CuI) pode ser calculada somando as massas atômicas de seus elementos constituintes. O cobre tem massa molar de aproximadamente 63,55 g/mol, enquanto o iodo tem massa molar de aproximadamente 126,90 g/mol. Assim, a massa molar de CuI é aproximadamente 190,45 g/mol.
Ponto de ebulição do iodeto de cobre
O iodeto cuproso não possui ponto de ebulição bem definido, pois sofre decomposição antes de atingir seu ponto de ebulição. Quando aquecido, decompõe-se em cobre metálico e iodo gasoso, tornando-o inadequado para a determinação tradicional do ponto de ebulição.
Ponto de fusão do iodeto de cobre
O ponto de fusão do iodeto cuproso é relativamente baixo em comparação com muitos outros haletos metálicos. Seu ponto de fusão é de cerca de 606 graus Celsius (1.123 graus Fahrenheit). A esta temperatura, o iodeto cuproso sólido se transforma em um líquido fundido.
Densidade de iodeto de cobre g/mL
O iodeto cuproso tem uma densidade de aproximadamente 5,67 g/mL. Este valor representa a massa de iodeto cuproso por unidade de volume. Isto indica que o iodeto cuproso é relativamente denso em comparação com alguns outros compostos inorgânicos.
Peso molecular do iodeto de cobre
O peso molecular do iodeto cuproso, também chamado de massa molar, é de aproximadamente 190,45 g/mol. É a soma dos pesos atômicos de todos os átomos presentes em uma molécula de iodeto cuproso (CuI).
Estrutura do iodeto de cobre
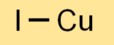
O iodeto cuproso existe em várias estruturas cristalinas, incluindo as fases alfa, beta e gama. A forma mais comum é a fase alfa, que possui uma estrutura de mistura de zinco. Forma uma rede de átomos de cobre e iodo.
Solubilidade do iodeto de cobre
A solubilidade do iodeto cuproso em diferentes solventes varia. É pouco solúvel em água e sua solubilidade pode ser aumentada pela adição de íons iodeto. Solventes orgânicos como o etanol podem dissolvê-lo com mais eficácia do que a água.
| Aparência | Sólido amarelo brilhante |
| Gravidade Específica | 5,67g/ml |
| Cor | AMARELO |
| Cheiro | Inodoro |
| Massa molar | 190,45 g/mol |
| Densidade | 5,67g/cm³ |
| Ponto de fusão | 606°C (1123°F) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Pouco solúvel |
| Solubilidade | Solúvel em solventes orgânicos como etanol e éter |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não aplicável |
Observe que algumas propriedades, como ponto de fulgor, pressão de vapor, densidade de vapor, pKa e pH, não são aplicáveis ou estão disponíveis para o iodeto cuproso devido à sua natureza e às suas propriedades.
Segurança e perigos do iodeto de cobre
O iodeto cuproso apresenta certos riscos de segurança que devem ser considerados durante o manuseio. É essencial usar equipamentos de proteção individual (EPI) adequados, como luvas e óculos de proteção, para evitar o contato com a pele e os olhos. A inalação de poeira ou vapores deve ser evitada, pois pode causar irritação respiratória. O iodeto cuproso é moderadamente tóxico se ingerido e não deve ser consumido. Além disso, é essencial trabalhar com iodeto cuproso em área bem ventilada para evitar o acúmulo de vapor. O armazenamento adequado em recipientes bem fechados, longe de substâncias incompatíveis, é crucial para minimizar riscos potenciais.
| Símbolos de perigo | Irritante |
| Descrição de segurança | Causa irritação na pele e nos olhos. Moderadamente tóxico se ingerido. Evite a inalação. Usar em uma área bem ventilada. Use EPI apropriado. |
| Números de identificação da ONU | Não aplicável |
| Código SH | Não aplicável |
| Classe de perigo | Não aplicável |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Moderadamente tóxico se ingerido |
Métodos para a síntese de iodeto de cobre
O iodeto cuproso pode ser sintetizado por diferentes métodos. Um método comum para sintetizar iodeto cuproso envolve misturar Cu finamente pulverizado com iodo e aquecer a mistura em um ambiente controlado. À medida que a temperatura aumenta, o Cu reage com o iodo para formar iodeto cuproso.
Outra abordagem é adicionar óxido de cobre (CuO) ou hidróxido de cobre (Cu(OH)2) ao ácido iodídrico (HI) e aquecer a mistura. A reação entre o ácido e o composto de cobre resulta na formação de iodeto cuproso.
O iodeto cuproso também pode ser obtido misturando um sal de Cu, tal como CuSO4 , com um sal de iodeto solúvel, tal como iodeto de potássio (KI) em água. Esta reação leva à precipitação de iodeto cuproso.
Além disso, uma reação de duplo deslocamento entre um sal solúvel de Cu, como o sulfato de cobre, e um sal de iodeto solúvel, como o iodeto de sódio (NaI) em uma solução aquosa, produz iodeto cuproso sólido como precipitado. .
Esses métodos de síntese oferecem diferentes rotas para a obtenção do iodeto cuproso, permitindo seu uso em uma ampla gama de aplicações na química e na indústria.
Usos do iodeto de cobre
O iodeto cuproso encontra aplicações versáteis em vários campos devido às suas propriedades únicas. Aqui estão alguns de seus principais usos:
- Síntese orgânica: O iodeto cuproso serve como catalisador em reações orgânicas, promovendo diversas reações de acoplamento, como as reações de Ullmann, Sonogashira e Glaser.
- Semicondutores: É utilizado na produção de semicondutores, principalmente como material semicondutor tipo P.
- Dispositivos Fotovoltaicos: O iodeto cuproso é usado em células solares e fotodetectores devido à sua fotocondutividade e propriedades de absorção de luz.
- Galvanoplastia: É utilizado como aditivo eletrolítico em banhos de galvanoplastia para melhorar a deposição de cobre.
- Pigmentos: A cor amarela brilhante do iodeto cuproso o torna valioso como pigmento nas indústrias de cerâmica e vidro.
- Tinta anti-incrustante: É um componente essencial das tintas anti-incrustantes para aplicações marítimas.
- Reagentes Químicos: O iodeto cuproso é utilizado em laboratórios como reagente químico para diversos testes e experimentos.
- Agentes de contraste de raios X: Em imagens médicas, agentes de contraste de iodeto cuproso são usados para exames de raios X.
- Preservante de madeira: O iodeto cuproso protege a madeira do apodrecimento e da infestação de insetos, tornando-o útil na indústria madeireira.
- Fungicidas: Atua como um fungicida eficaz, protegendo culturas e plantas de infecções fúngicas.
As inúmeras aplicações do iodeto cuproso demonstram sua importância em muitas indústrias, desde eletrônica e fotovoltaica até agricultura e medicina.
Questões:
P: Como fazer iodeto de cobre?
R: O iodeto cuproso pode ser sintetizado pela reação de cobre metálico ou óxido de cobre com iodo ou por reações de duplo deslocamento usando sulfato de cobre e iodeto de potássio.
P: O iodeto cuproso é solúvel em água?
R: Não, o iodeto cuproso (CuI2) é insolúvel em água.
P: Qual é a equação molecular para a reação do nitrato de cobre II e do iodeto de potássio?
R: A equação molecular é Cu(NO3)2 + 2KI → CuI2 + 2KNO3.
P: Qual é a fórmula do iodeto cuproso?
R: A fórmula do iodeto cuproso é CuI2.
P: O iodeto de cobre (II) é insolúvel?
R: Sim, o iodeto cuproso (II) (CuI2) é insolúvel em água.
P: É seguro misturar sulfato de cobre e iodeto de potássio?
R: A mistura de CaSO4 e iodeto de potássio pode produzir iodeto cuproso, mas deve-se tomar cuidado devido à reatividade dos produtos químicos envolvidos.
P: Qual é o nome do composto de fórmula CUI2?
R: O composto com a fórmula CUI2 é o iodeto cuproso (II).
P: CUI2 é um precipitado?
R: Sim, CUI2 pode formar precipitado em algumas reações devido à sua baixa solubilidade em água.
P: O CUI2 é solúvel em água?
R: Não, CUI2 não é solúvel em água.
P: O CUI2 é solúvel?
R: Não, CUI2 não é solúvel na maioria dos solventes comuns.
P: O que torna o CUI2 intratável?
R: A baixa solubilidade do CUI2 se deve à sua forte ligação iônica entre o cobre e o iodo, levando à dissociação limitada na água.
