O cloreto de zinco (ZnCl2) é um composto cristalino branco. É utilizado em diversas aplicações industriais, como fluxos de soldagem, síntese química e galvanização. É muito solúvel em água.
| Nome IUPAC | Cloreto de zinco |
| Fórmula molecular | ZnCl2 |
| Número CAS | 7646-85-7 |
| Sinônimos | Manteiga de zinco; Dicloreto de zinco; Cloreto de zinco(II); Manteiga de zinco; CI77043 |
| InChI | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
Propriedades do cloreto de zinco
Fórmula de Cloreto de Zinco
A fórmula química do dicloreto de zinco é ZnCl2. É composto por um átomo de zinco (Zn) e dois átomos de cloro (Cl). Este composto iônico forma um sólido cristalino branco com uma estrutura distinta.
Massa molar de cloreto de zinco
A massa molar do dicloreto de zinco é de aproximadamente 136,29 gramas por mol (g/mol). É derivado da soma das massas atômicas de um átomo de zinco e dois átomos de cloro.
Ponto de ebulição do cloreto de zinco
O dicloreto de zinco tem um ponto de ebulição relativamente alto, em torno de 732 graus Celsius (C) ou 1.350 graus Fahrenheit (F). Nessa temperatura, ele passa do estado líquido para o gasoso.
Ponto de fusão do cloreto de zinco
O ponto de fusão do dicloreto de zinco é de aproximadamente 290 graus Celsius (C) ou 554 graus Fahrenheit (F). A esta temperatura, o dicloreto de zinco sólido passa para o estado líquido.
Densidade de cloreto de zinco g/mL
A densidade do dicloreto de zinco é de aproximadamente 2,91 gramas por mililitro (g/mL) à temperatura ambiente. Esta propriedade descreve sua massa por unidade de volume.
Peso molecular do cloreto de zinco
O peso molecular do dicloreto de zinco, calculado a partir de sua fórmula química, é de aproximadamente 136,29 g/mol. Este valor representa a soma dos pesos atômicos de seus átomos constituintes.
Estrutura do cloreto de zinco
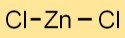
O dicloreto de zinco tem uma estrutura cristalina com cátions Zn2+ e Clanions mantidos juntos por ligações iônicas. O arranjo forma uma rede tridimensional estável e ordenada.
Solubilidade do cloreto de zinco
O dicloreto de zinco é muito solúvel em água, o que significa que se dissolve facilmente na presença de moléculas de água. Esta propriedade contribui para sua ampla utilização em diversas aplicações industriais e processos químicos.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,91g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 136,29 g/mol |
| Densidade | 2,91g/cm³ |
| Ponto de fusão | 290°C (554°F) |
| Ponto de ebulição | 732°C (1350°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel em água |
| Solubilidade | Solúvel em solventes orgânicos como álcool e acetona |
| Pressão de vapor | 1 mmHg a 359°C |
| Densidade do vapor | 5,4 (ar = 1) |
| pKa | -1,9 |
| pH | ~5 (solução 0,1 M em água) |
Segurança e perigos do cloreto de zinco
O dicloreto de zinco apresenta certos riscos de segurança que requerem manuseio cuidadoso. O contato direto com a pele ou os olhos pode causar irritação e queimaduras. A inalação dos seus vapores pode irritar o sistema respiratório. É essencial usar equipamentos de proteção como luvas e óculos de proteção ao manusear o composto. Além disso, deve ser armazenado em local bem ventilado, longe de substâncias incompatíveis. Em caso de ingestão ou exposição acidental, procure imediatamente atendimento médico. Evite liberá-lo no meio ambiente, pois pode ser prejudicial à vida aquática. Seguindo medidas e diretrizes de segurança adequadas, os riscos associados ao dicloreto de zinco podem ser minimizados de forma eficaz.
| Símbolos de perigo | Corrosivo (C); Nocivo (Xn) |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Usar em uma área bem ventilada. Use luvas e óculos de proteção. Em caso de contato ou ingestão, consulte um médico. Não libere no meio ambiente. Manter afastado de substâncias incompatíveis. |
| Números de identificação da ONU | Nº ONU 2331 (Dicloreto de zinco anidro); Nº ONU 2332 (dicloreto de zinco, solução) |
| Código SH | 28273990 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II (Perigo médio) |
| Toxicidade | Nocivo por ingestão ou inalação. |
Métodos para a síntese de cloreto de zinco
Vários métodos permitem a síntese de dicloreto de zinco.
Uma abordagem comum envolve a reação do óxido de zinco (ZnO) com ácido clorídrico (HCl) . Neste método, um químico adiciona lentamente ZnO a uma solução de HCl enquanto agita continuamente. A reação produz dicloreto de zinco e água como subprodutos. Outro método é combinar diretamente o zinco metálico com cloro gasoso (Cl2). Esta reação requer um controle cuidadoso da temperatura e da pressão para garantir um resultado bem-sucedido.
Um processo alternativo envolve a dissolução do zinco metálico em uma solução de HCl, resultando na formação de dicloreto de zinco e gás hidrogênio (H2). O tratamento do HCl com carbonato de zinco (ZnCO3) ou hidróxido de zinco (Zn(OH)2) produz dicloreto de zinco, água e dióxido de carbono (CO2) como subprodutos.
O sulfato de zinco (ZnSO4) e o cloreto de bário (BaCl2) sofrem uma reação de dupla decomposição para produzir dicloreto de zinco e também para formar sulfato de bário (BaSO4). Ao misturar estes dois compostos, o dicloreto de zinco precipita, enquanto o sulfato de bário (BaSO4) permanece na solução.
Cada um destes métodos fornece uma rota para a síntese do dicloreto de zinco e a escolha do método depende de fatores como disponibilidade de reagentes, condições de reação e pureza desejada do produto final.
Usos do cloreto de zinco
O dicloreto de zinco encontra uma ampla gama de aplicações em diversas indústrias devido às suas propriedades versáteis. Aqui estão alguns usos importantes do dicloreto de zinco:
- Galvanização: O dicloreto de zinco desempenha um papel essencial no processo de galvanização para prevenir a corrosão de metais como aço e ferro. Forma um revestimento protetor de zinco, melhorando sua longevidade e durabilidade.
- Fluxo de Solda: Nas operações de brasagem, o dicloreto de zinco atua como um fluxo para remover óxidos metálicos da superfície dos metais, proporcionando melhor adesão e uma ligação forte entre a solda e o metal.
- Síntese química: Serve como catalisador ou reagente em muitas reações químicas, como acilação e desidratação de Friedel-Crafts.
- Preservação de madeira: As aplicações de preservação de madeira usam dicloreto de zinco para proteger a madeira da podridão fúngica e de insetos, prolongando sua vida útil.
- Processamento Têxtil: Na indústria têxtil, facilita a produção de tecidos de algodão mercerizado, conferindo propriedades desejáveis como maior brilho e maior resistência.
- Eletrólito da bateria: O dicloreto de zinco atua como eletrólito em algumas baterias, como a bateria de zinco-carbono, ajudando a facilitar o fluxo de íons entre os eletrodos.
- Desodorante e antitranspirante: É um ingrediente comum em antitranspirantes devido às suas propriedades adstringentes que ajudam a reduzir a produção de suor e a controlar o odor corporal.
- Produtos farmacêuticos: O dicloreto de zinco encontra aplicação em diversas formulações farmacêuticas, principalmente em enxaguatórios bucais, pastilhas para a garganta e soluções anti-sépticas tópicas.
- Indústria de tingimento: A indústria de tingimento utiliza dicloreto de zinco como mordente no processo de tingimento para melhorar a solidez da cor dos tecidos com corantes.
- Formulações adesivas: Os fabricantes incorporam dicloreto de zinco em formulações adesivas para melhorar as propriedades de ligação de colas e cimentos.
A versatilidade do dicloreto de zinco o torna um composto essencial em muitos processos industriais e produtos de uso diário, contribuindo para o avanço de diversas indústrias importantes.
Questões:
P: O ZnCl2 é solúvel em água?
R: Sim, o ZnCl2 é altamente solúvel em água.
P: Qual é a equação iônica líquida para a reação de ZnCl2 com NaOH?
R: A equação iônica líquida é Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s).
P: O ZnCl2 é solúvel?
R: Sim, o ZnCl2 é solúvel em água.
P: O ZnCl2 é iônico ou molecular?
R: ZnCl2 é um composto iônico.
P: Que tipo de ligação ocorre no cloreto de zinco (II), ZnCl2?
A: A ligação iônica ocorre em ZnCl2.
P: Que mudança poderia diminuir a taxa de produção de ZnCl2?
R: A redução da temperatura de reação pode diminuir a taxa de produção de ZnCl2.
P: O ZnCl2 é sólido?
R: Sim, o ZnCl2 é um sólido à temperatura ambiente.
P: O ZnCl2 é um sal?
R: Sim, o ZnCl2 é considerado um sal.
P: Como você obterá cloreto de zinco do zinco?
R: A reação do zinco com ácido clorídrico produzirá cloreto de zinco.
P: Qual é a fórmula do cloreto de zinco?
R: A fórmula do cloreto de zinco é ZnCl2.
P: As baterias de cloreto de zinco são prejudiciais à terra?
R: Sim, as baterias de cloreto de zinco podem ser prejudiciais ao meio ambiente se não forem descartadas adequadamente.
P: Qual é a massa molar do cloreto de zinco?
R: A massa molar do cloreto de zinco é aproximadamente 136,29 g/mol.
