O óxido de lítio (Li2O) é um composto feito de lítio e oxigênio. Apresenta fortes propriedades iônicas e é amplamente utilizado em baterias devido ao seu alto potencial eletroquímico.
| Nome IUPAC | Óxido de lítio |
| Fórmula molecular | Li2O |
| Número CAS | 12142-77-7 |
| Sinônimos | Óxido de lítio(I); Óxido de dilítio; Lítia; Oxolítio; UNII-06T3K8P3KU |
| InChI | InChI=1S/2Li.O |
Fórmula de Óxido de Lítio
Fórmula de Óxido de Lítio
A fórmula química do óxido de dilítio é Li2O. Representa a combinação de dois átomos de lítio (Li) e um átomo de oxigênio (O). Este composto simples e estável é essencial em diversas aplicações industriais.
Massa molar de óxido de lítio
A massa molar do Li2O é aproximadamente 29,88 g/mol. É calculado adicionando as massas atômicas de dois átomos de lítio (6,94 g/mol cada) e um átomo de oxigênio (16,00 g/mol).
Ponto de ebulição do óxido de lítio
O óxido de dilítio tem um ponto de ebulição impressionante de cerca de 2.463 graus Celsius (4.465 graus Fahrenheit). Este ponto de ebulição excepcionalmente alto o torna útil em indústrias que exigem extrema resistência ao calor.
Ponto de fusão do óxido de lítio
O ponto de fusão do óxido de dilítio é de aproximadamente 1.450 graus Celsius (2.642 graus Fahrenheit). Quando exposto a essa temperatura, passa do estado sólido para o líquido, facilitando diversos processos de fabricação.
Densidade de óxido de lítio g/mL
O óxido de dilítio tem uma densidade de aproximadamente 2,01 g/mL. Este valor representa a massa do composto por unidade de volume e é essencial para determinar suas propriedades e aplicações.
Peso molecular do óxido de lítio
O peso molecular do Li2O é 29,88 g/mol. É a soma dos pesos atômicos de seus elementos constituintes, lítio e oxigênio. Este valor facilita os cálculos estequiométricos.
Estrutura do óxido de lítio
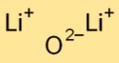
O óxido de dilítio possui uma estrutura cristalina iônica simples. É composto de cátions de lítio (Li+) e ânions de óxido (O2-) mantidos juntos por fortes forças eletrostáticas. Este arranjo contribui para sua estabilidade e condutividade.
Solubilidade do óxido de lítio
O óxido de dilítio tem baixa solubilidade em água. Reage com a água para formar hidróxido de lítio, limitando sua dissolução. No entanto, apresenta alguma solubilidade em alguns solventes não aquosos e sais fundidos.
Concluindo, o óxido de dilítio é um composto importante com diversas características e aplicações. Sua estrutura estável, altos pontos de fusão e ebulição o tornam valioso em indústrias como cerâmica, fabricação de vidro e como componente de baterias especializadas. Compreender suas propriedades nos permite explorar seu potencial para diversos fins.
| Aparência | Sólido branco |
| Gravidade Específica | 2,01 g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 29,88 g/mol |
| Densidade | 2,01 g/ml |
| Ponto de fusão | 1.450°C (2.642°F) |
| Ponto de ebulição | 2.463°C (4.465°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage com água |
| Solubilidade | Baixa solubilidade em água, forma de hidróxido de lítio |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não aplicável |
| pH | Não aplicável |
Observe que algumas propriedades como ponto de fulgor, pressão de vapor, densidade de vapor, pKa e pH não são aplicáveis ou estão disponíveis para Li2O devido à sua natureza química e comportamento.
Segurança e perigos do óxido de lítio
O óxido de dilítio apresenta certas preocupações e perigos de segurança. Reage fortemente com a água, produzindo hidróxido de lítio, que é cáustico e pode causar irritação na pele e nos olhos. A inalação de poeira ou vapores pode causar irritação respiratória. O composto não é classificado como altamente tóxico, mas deve ser manuseado com cuidado para evitar contato com a pele ou olhos. Ventilação adequada e equipamento de proteção individual são essenciais ao trabalhar com óxido de dilítio. Em caso de ingestão acidental é necessária atenção médica imediata. Além disso, deve ser armazenado longe de substâncias incompatíveis para evitar qualquer risco potencial de incêndio ou explosão.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Reage com água. Causa irritação na pele e nos olhos. Manuseie com cuidado. Evite a inalação de poeira ou vapores. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2825.70.00 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | III |
| Toxicidade | Não é muito tóxico, mas requer cautela. Evite a ingestão e o contato com a pele ou os olhos. |
Métodos de síntese de óxido de lítio
Vários métodos permitem a síntese de óxido de dilítio.
Uma abordagem comum envolve a reação do metal lítio com oxigênio ou ar em altas temperaturas. Neste processo, o gás oxigênio facilita o aquecimento do metal lítio, resultando na formação de óxido de dilítio.
Outro método é a decomposição térmica de sais de lítio, como carbonato de lítio ou hidróxido de lítio , a temperaturas elevadas. Ao submeter estes sais ao calor, eles se decompõem para produzir óxido de dilítio.
Além disso, para produzir óxido de dilítio, o hidróxido de lítio pode ser usado como precursor. É primeiro desidratado por aquecimento, transformando-o na forma de óxido desejada.
Outra técnica envolve o uso de minerais ou minérios contendo lítio. Os processos químicos extraem compostos de lítio dessas fontes naturais, que, por sua vez, passam por processamento adicional para produzir óxido de dilítio.
É essencial observar que cada método de síntese pode apresentar vantagens e desafios específicos em termos de custo, eficiência e pureza. Cientistas e engenheiros consideram esses fatores ao selecionar o método mais apropriado para a produção de óxido de dilítio para atender a requisitos industriais ou de pesquisa específicos.
Usos do óxido de lítio
O óxido de dilítio (Li2O) encontra aplicações versáteis em diversas indústrias devido às suas propriedades únicas. Aqui estão alguns usos principais:
- Indústria cerâmica: O óxido de dilítio é um componente crucial da cerâmica, melhorando a sua resistência mecânica e estabilidade térmica. Também reduz a temperatura de cozimento, economizando energia durante o processo de fabricação.
- Produção de vidro: Na indústria do vidro, o óxido de dilítio atua como fundente, diminuindo a temperatura de fusão do vidro e melhorando sua resistência ao ataque químico, resultando em produtos de vidro de alta qualidade.
- Tecnologia de bateria: O óxido de dilítio serve como precursor na produção de baterias de íon-lítio. Contribui para os materiais catódicos da bateria, melhorando assim a sua capacidade de armazenamento de energia e desempenho geral.
- Dessecante: A forte afinidade do óxido de dilítio pela água o torna um dessecante eficaz, usado para remover a umidade de certos ambientes, como em sistemas de ar condicionado e purificação de gás.
- Metalurgia: Nos processos metalúrgicos, o óxido de dilítio auxilia no refino de metais, removendo impurezas.
- Vidros Especiais: A produção de vidros especiais para diversas aplicações, como óptica, eletrônica e instrumentos científicos, envolve o uso de óxido de dilítio.
- Catalisador: O óxido de dilítio serve como catalisador em certas reações químicas, facilitando a transformação de reagentes em produtos desejados.
- Indústria nuclear: Na indústria nuclear, o óxido de dilítio funciona como moderador de nêutrons, controlando a taxa das reações de fissão nuclear.
A diversidade de aplicações destaca a importância do óxido de dilítio no avanço da tecnologia, fabricação e pesquisa científica. Suas propriedades únicas continuam a impulsionar a inovação em vários setores, tornando-o um composto valioso com uma ampla gama de utilizações práticas.
Questões:
P: Que equação mostra que o óxido de lítio é formado a partir da reação entre o oxigênio e o lítio?
R: 4Li + O2 → 2Li2O
P: Qual é a massa molar do óxido de lítio, Li2O?
R: A massa molar do Li2O é aproximadamente 29,88 g/mol.
P: Qual é a fórmula do óxido de lítio?
R: A fórmula do óxido de dilítio é Li2O.
P: O óxido de lítio é iônico ou covalente?
R: O óxido de dilítio é iônico.
P: Qual é o número de oxidação do lítio em uma ligação iônica?
R: O número de oxidação do lítio em uma ligação iônica é +1.
P: Número de coordenação do lítio em Li2O?
R: O número de coordenação do lítio em Li2O é 4.
P: O Li2O é iônico ou covalente?
R: Li2O é iônico.
P: Qual das seguintes reações está associada à energia de rede do Li2O (ΔH°latt)?
A: A reação: Li+(g) + O2-(g) → Li2O(s)
P: Qual é a massa molar do óxido de lítio, Li2O?
R: A massa molar do Li2O é aproximadamente 29,88 g/mol.
P: Qual dos seguintes será produzido ao queimar lítio metálico (Li)? O2, LiO, H2O, Li2O?
R: O Li2O será produzido durante a combustão do lítio metálico (Li).
P: Quantos gramas existem em 4,5 moles de Li2O?
R: Existem aproximadamente 134,46 gramas em 4,5 moles de Li2O.
