O óxido de ouro (Au2O3) é um composto feito de ouro e oxigênio. Apresenta propriedades diferentes do ouro metálico, o que o torna interessante em diversas aplicações científicas e industriais.
| Nome IUPAC | Óxido de ouro (III) |
| Fórmula molecular | Au2O3 |
| Número CAS | 1303-58-8 |
| Sinônimos | Óxido áurico, sesquióxido de ouro, trióxido de ouro, trióxido de digold |
| InChI | InChI=1S/2Au.3O |
Propriedades do óxido de ouro (III)
Fórmula de Óxido de Ouro
A fórmula do trióxido de ouro é Au2O3. É composto por dois átomos de ouro e três átomos de oxigênio. Esta fórmula química indica a proporção dos elementos no composto.
Massa molar de óxido de ouro
A massa molar do trióxido de ouro (Au2O3) pode ser calculada somando as massas atômicas de seus elementos constituintes. A massa molar do ouro (Au) é 196,97 g/mol e a do oxigênio (O) é 16,00 g/mol. Portanto, a massa molar do Au2O3 é aproximadamente 441,97 g/mol.
Ponto de ebulição do óxido de ouro
O trióxido de ouro não tem um ponto de ebulição distinto, pois sofre decomposição antes de atingir o estado de ebulição. Quando aquecido, ele se decompõe em seus elementos constituintes.
Ponto de fusão do óxido de ouro
O trióxido de ouro tem um ponto de fusão de aproximadamente 1.600 °C (2.912 °F). A esta temperatura, o trióxido de ouro sólido transita para o estado líquido, facilitando diversas aplicações em processos de alta temperatura.
Densidade de óxido de ouro g/mL
A densidade do trióxido de ouro é de aproximadamente 11,34 g/mL. Este valor indica sua massa por unidade de volume e significa sua alta densidade em comparação com muitos outros materiais.
Peso molecular do óxido de ouro
O peso molecular do trióxido de ouro (Au2O3) é de aproximadamente 441,97 g/mol. Este valor representa a soma dos pesos atômicos de todos os átomos de uma molécula do composto.
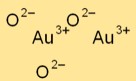
Estrutura do óxido de ouro
O trióxido de ouro (Au2O3) possui uma estrutura cristalina complexa. Apresenta um arranjo de rede romboédrica, com átomos de ouro e oxigênio formando padrões específicos dentro da rede cristalina.
Solubilidade do óxido de ouro
O trióxido de ouro (Au2O3) é geralmente insolúvel em água e na maioria dos solventes orgânicos. Apresenta baixa solubilidade, o que significa que apenas vestígios se dissolvem, levando à sua frequentemente baixa reatividade em soluções aquosas.
| Aparência | Sólido |
| Gravidade Específica | N / D |
| Cor | Preto ou preto acastanhado |
| Cheiro | Inodoro |
| Massa molar | 441,97 g/mol |
| Densidade | 11,34g/ml |
| Ponto de fusão | 1600°C (2912°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | N / D |
| Solubilidade em Água | Insolúvel |
| Solubilidade | baixa reatividade em soluções aquosas |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | N / D |
Segurança e perigos do óxido de ouro
O trióxido de ouro levanta várias considerações de segurança e perigo. Pode ser irritante se entrar em contato com a pele, os olhos ou o sistema respiratório. Equipamentos de proteção adequados, como luvas e óculos de proteção, devem ser usados durante o manuseio. Além disso, o trióxido de ouro não é adequado para ingestão ou inalação, pois pode causar efeitos adversos à saúde. Ao trabalhar com este composto, garanta uma boa ventilação para minimizar o risco de exposição à poeira ou vapores. Além disso, em caso de ingestão ou exposição acidental, procure atendimento médico imediatamente. Práticas adequadas de armazenamento e manuseio são essenciais para garantir o uso seguro do trióxido de ouro em ambientes laboratoriais e industriais.
| Símbolos de perigo | Irritante |
| Descrição de segurança | Irritante, Evitar a inalação, Corrosão da pele, Lesões oculares graves |
| Números de identificação da ONU | N / D |
| Código SH | N / D |
| Classe de perigo | N / D |
| Grupo de embalagem | N / D |
| Toxicidade | Fraco |
Observe que algumas propriedades, como identificadores ONU, código HS, classe de perigo e grupo de embalagem, podem não ser aplicáveis ou bem definidas para o óxido de ouro.
Métodos de síntese de óxido de ouro
Vários métodos permitem a síntese de trióxido de ouro.
Uma abordagem comum envolve a reação do ouro metálico com o gás ozônio em temperaturas elevadas. Durante este processo, o ouro reage com o ozônio para formar trióxido de ouro. Outro método inclui a decomposição térmica de sais de ouro, como nitrato de ouro ou hidróxido de ouro. Quando aquecidos, esses compostos se decompõem, produzindo trióxido de ouro como um dos produtos.
O trióxido de ouro pode ser preparado por precipitação. Isto envolve a mistura de uma solução de sal de ouro com um agente precipitante adequado, tal como um hidróxido de metal alcalino, NaOH . Posteriormente, o processamento adicional do precipitado resultante produz trióxido de ouro puro.
Além disso, a eletrólise de um eletrólito contendo ouro pode levar à formação de trióxido de ouro na superfície do ânodo. Este método é particularmente útil para produzir filmes finos de trióxido de ouro.
Os pesquisadores podem escolher um método de síntese específico com base em fatores como pureza desejada, tamanho de partícula e aplicação de trióxido de ouro. O controle cuidadoso das condições de reação é essencial para obter o produto desejado com propriedades ideais para usos específicos.
Usos do óxido de ouro
O trióxido de ouro encontra diversas aplicações devido às suas propriedades únicas. Aqui estão seus usos:
- Catálise: O trióxido de ouro atua como catalisador em certas reações químicas, incluindo a oxidação do monóxido de carbono e outros hidrocarbonetos. É valioso em processos industriais por sua eficiência catalítica.
- Coloração de vidro: O trióxido de ouro confere uma cor vermelha característica ao vidro, tornando-o útil para fins decorativos e para a criação de arte em vitrais.
- Pesquisa: Os cientistas usam trióxido de ouro em vários estudos de pesquisa, incluindo pesquisa de catálise, ciência de materiais e nanotecnologia.
- Fotocatálise: O trióxido de ouro apresenta propriedades fotocatalíticas, permitindo a decomposição de poluentes orgânicos na água e no ar quando expostos à luz.
- Células de combustível: O trióxido de ouro serve como catalisador nas células de combustível, melhorando as reações eletroquímicas e melhorando sua eficiência.
- Síntese química: O trióxido de ouro facilita a síntese de outros compostos de ouro, como nanopartículas de ouro, que encontram aplicações em diversos campos.
- Medicina: Os pesquisadores exploraram as potenciais aplicações médicas do trióxido de ouro, incluindo o tratamento do câncer e suas propriedades antimicrobianas.
- Tecnologia de sensores: Os fabricantes usam sensores de trióxido de ouro em dispositivos de detecção de gases, monitoramento ambiental e detecção de substâncias perigosas.
- Eletrônicos: Os fabricantes utilizam filmes finos de trióxido de ouro em eletrônicos, por exemplo na fabricação de semicondutores e resistores, devido ao seu alto ponto de fusão e estabilidade.
- Nanotecnologia: Na nanotecnologia, os investigadores estão a utilizar nanopartículas de trióxido de ouro como materiais promissores para sistemas de administração de medicamentos e diagnósticos médicos, graças à sua biocompatibilidade.
Essas aplicações demonstram a versatilidade e a importância do trióxido de ouro em diversas indústrias, contribuindo para avanços na tecnologia, ciência e saúde.
Questões:
P: Qual é o número de oxidação do Au em Au2O3?
R: O número de oxidação de Au em Au2O3 é +3.
P: Qual volume de O2 nas CNTP é produzido a partir da reação de 212 gramas de Au2O3?
R: Aproximadamente 160,7 litros de O2 nas CNTP serão produzidos a partir da reação de 212 gramas de Au2O3.
P: Para que é usado o Au2O3?
R: Au2O3 tem aplicações como catalisador em eletrônica, nanotecnologia, coloração de vidro e estudos de pesquisa.
P: Quantos gramas de ouro existem em uma tonelada métrica (1000 kg) de Au2O3?
R: Haverá aproximadamente 432,09 gramas de ouro em uma tonelada métrica (1.000 kg) de Au2O3.
P: Quantos gramas de ouro existem em uma tonelada de Au2O3?
R: Haverá aproximadamente 432.090 gramas de ouro em uma tonelada de Au2O3.
P: O óxido de ouro (III) é iônico ou molecular?
R: O óxido de ouro (III) (Au2O3) é um composto iônico.
P: Para que é usado o óxido de ouro (III)?
R: O óxido de ouro (III) é usado em aplicações de catálise, eletrônica, nanotecnologia, coloração de vidro e células de combustível.
P: Qual é a fórmula química do óxido de ouro (III)?
R: A fórmula química do óxido de ouro (III) é Au2O3.
