O tetracloreto de carbono é um líquido incolor com odor adocicado. Era comumente usado como solvente, mas sua produção e uso diminuíram devido aos seus efeitos nocivos à saúde e ao meio ambiente.
| Nome IUPAC | Tetraclorometano |
| Fórmula molecular | CCl4 |
| Número CAS | 56-23-5 |
| Sinônimos | Tet de carbono, Tetrafórmio, Perclorometano, Tetrasol |
| InChI | InChI=1S/CCl4/c2-1(3,4)5 |
Propriedades do tetracloreto de carbono
Fórmula de tetracloreto de carbono
A fórmula química do tetracloreto de carbono é CCl4. Representa uma molécula composta por um átomo de carbono ligado a quatro átomos de cloro. A fórmula fornece informações essenciais sobre a composição elementar e o arranjo dos átomos dentro do composto.
Massa molar de tetracloreto de carbono
A massa molar do tetraclorometano é calculada somando as massas atômicas de seus elementos constituintes. O carbono tem massa molar de 12,01 g/mol, enquanto o cloro tem massa molar de 35,45 g/mol. Somando esses valores, a massa molar do tetraclorometano é de aproximadamente 153,82 g/mol.
Ponto de ebulição do tetracloreto de carbono
O tetraclorometano tem um ponto de ebulição relativamente alto de 76,72°C (170,1°F). Isto significa que à pressão atmosférica padrão, o composto muda de líquido para gás a essa temperatura. O ponto de ebulição reflete a força das forças intermoleculares dentro da substância.
Ponto de fusão de tetracloreto de carbono
O ponto de fusão do tetraclorometano é -22,92°C (-9,26°F). Esta é a temperatura na qual a forma sólida do composto se transforma em líquido. O ponto de fusão fornece informações sobre a força das ligações que mantêm os átomos juntos dentro da rede cristalina.
Densidade de tetracloreto de carbono g/mL
A densidade do tetraclorometano é de aproximadamente 1,586 g/mL. Densidade refere-se à massa de uma substância por unidade de volume. A densidade do tetraclorometano indica que ele é mais denso que a água, que tem densidade de 1 g/mL.
Peso molecular do tetracloreto de carbono
O peso molecular do tetraclorometano é calculado adicionando os pesos atômicos de seus átomos constituintes. Com um átomo de carbono (12,01 g/mol) e quatro átomos de cloro (35,45 g/mol cada), o peso molecular do tetraclorometano é de aproximadamente 153,82 g/mol.
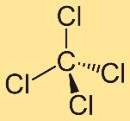
Estrutura do tetracloreto de carbono
A estrutura do tetraclorometano consiste em um átomo de carbono central ligado a quatro átomos de cloro. Esses átomos de cloro estão posicionados simetricamente ao redor do átomo de carbono, formando uma geometria tetraédrica. Esta estrutura contribui para as propriedades e comportamento do composto.
Solubilidade do tetracloreto de carbono
O tetraclorometano é pouco solúvel em água, com uma solubilidade de aproximadamente 0,8 g/L a 20°C. No entanto, apresenta maior solubilidade em solventes orgânicos como etanol, éter e benzeno. As características de solubilidade são influenciadas pelas forças intermoleculares e pela polaridade das substâncias envolvidas.
| Aparência | Líquido incolor |
| Gravidade Específica | 1.586 |
| Cor | N / D |
| Cheiro | Macio |
| Massa molar | 153,82 g/mol |
| Densidade | 1.586g/mL |
| Ponto de fusão | -22,92°C (-9,26°F) |
| Ponto de ebulição | 76,72°C (170,1°F) |
| Ponto flash | N / D |
| Solubilidade em Água | 0,8 g/L a 20°C |
| Solubilidade | Solúvel em solventes orgânicos como etanol, éter e benzeno |
| Pressão de vapor | 11,9 mmHg a 20°C |
| Densidade do vapor | 5,3 (ar = 1) |
| pKa | N / D |
| pH | N / D |
Segurança e perigos do tetracloreto de carbono
O tetraclorometano apresenta riscos de segurança significativos. É considerado altamente tóxico e pode prejudicar gravemente a saúde humana. A inalação de seus vapores pode causar irritação respiratória, tontura, náusea e até danos ao fígado e aos rins. O contato da pele com o líquido pode causar queimaduras e irritação. O composto também é um conhecido agente cancerígeno, apresentando riscos à saúde a longo prazo. Além disso, o tetraclorometano é perigoso para o meio ambiente, com potencial para contaminar o solo e a água. Devido a estes perigos, a sua produção e utilização foram significativamente restringidas, a fim de minimizar a exposição e proteger a saúde humana e o ambiente. Protocolos adequados de manuseio, armazenamento e descarte devem ser seguidos para mitigar os riscos associados ao tetraclorometano.
| Símbolos de perigo | T, Xn |
| Descrição de segurança | Muito tóxico; Prejudicial |
| Números de identificação da ONU | Um 1846 |
| Código SH | 2903.14.0000 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II |
| Toxicidade | Toxicidade aguda, cancerígena |
Métodos para a síntese de tetracloreto de carbono
O tetraclorometano pode ser sintetizado por diferentes métodos. Um método comum envolve a reação entre cloro gasoso (Cl2) e dissulfeto de carbono (CS2) na presença de um catalisador como o cloreto de alumínio (AlCl3).
Neste processo, o gás cloro reage com o vapor de dissulfeto de carbono para produzir tetraclorometano e enxofre. A reação prossegue da seguinte forma:
Cl2 + CS2 → CCl4 + S
Outro método envolve a reação entre metano (CH4) e cloro gasoso. Sob condições controladas, o metano reage com o cloro na presença de luz ultravioleta (UV) ou calor para produzir tetraclorometano e cloreto de hidrogênio. A reação prossegue da seguinte forma:
CH4 + 4Cl2 → CCl4 + 4HCl
A cloração do dissulfeto de carbono usando cloreto de hidrogênio (HCl) como agente de cloração produz tetraclorometano. Esta reação requer um catalisador, como o cloreto de ferro (III) (FeCl3). A reação prossegue da seguinte forma:
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
Ao sintetizar tetraclorometano, os indivíduos devem ter cautela devido à natureza perigosa do composto. Devem utilizar medidas rigorosas de segurança e equipamentos adequados para garantir o seu bem-estar e prevenir a contaminação ambiental.
Usos do tetracloreto de carbono
Várias aplicações utilizaram as propriedades únicas do tetraclorometano. Aqui estão alguns de seus usos:
- Solvente: Tetraclorometano uma vez dissolvido em óleos, graxas, borracha e ceras, servindo como solvente. No entanto, a sua toxicidade e as preocupações ambientais reduziram significativamente o uso de solventes.
- Extintor de Incêndio: Tetraclorometano utilizado para extinguir certos tipos de incêndios envolvendo equipamentos elétricos e líquidos inflamáveis. Alternativas mais seguras e os seus efeitos nocivos têm levado ao abandono gradual da sua utilização.
- Intermediário químico: O tetraclorometano tem servido como intermediário químico na produção de vários compostos, como refrigerantes, pesticidas e produtos farmacêuticos.
- Agente de limpeza: As indústrias anteriormente utilizavam tetraclorometano como agente de limpeza para superfícies metálicas e componentes eletrônicos. No entanto, os riscos para a saúde e o ambiente levaram a uma preferência por alternativas mais seguras.
- Reagente de laboratório: O tetraclorometano às vezes é usado como reagente ou solvente para reações e extrações específicas em laboratório. Os químicos geralmente preferem alternativas mais seguras e limitam o seu uso.
É fundamental notar que muitas destas aplicações diminuíram, ou mesmo cessaram completamente, devido aos efeitos nocivos do tetraclorometano na saúde humana e no ambiente. Consequentemente, o uso de tetraclorometano diminuiu significativamente e substâncias alternativas menos tóxicas e menos impactantes ao meio ambiente foram adotadas em diversas indústrias.
Questões:
P: Você ainda pode comprar substitutos para o tetracloreto de carbono?
R: Sim, existem substitutos para o tetraclorometano que são mais seguros e têm menor impacto ambiental.
P: Você ainda pode comprar tetracloreto de carbono?
R: O tetraclorometano é restrito em muitos países devido à sua toxicidade e riscos ambientais, por isso a sua disponibilidade para compra é limitada.
P: O tetracloreto de carbono é legal?
R: O tetraclorometano está sujeito a restrições legais em muitos países devido aos seus efeitos nocivos à saúde e ao meio ambiente.
P: O tetracloreto de carbono é alcalino ou ácido?
R: O tetraclorometano não é alcalino nem ácido; é um composto neutro.
P: O tetracloreto de carbono é polar ou apolar?
R: O tetraclorometano é uma molécula apolar devido à sua estrutura tetraédrica simétrica, que resulta em compartilhamento igual de elétrons.
P: Qual é a massa molar do tetracloreto de carbono?
R: A massa molar do tetraclorometano é aproximadamente 153,82 g/mol.
P: O que é tetracloreto de carbono?
R: O tetraclorometano é um composto líquido incolor usado principalmente como solvente no passado, mas seu uso agora é limitado devido à sua toxicidade e preocupações ambientais.
P: Qual é a fórmula química do tetracloreto de carbono?
R: A fórmula química do tetraclorometano é CCl4.
P: A ligação está em tetracloreto de carbono?
R: A ligação no tetraclorometano é covalente, com quatro ligações covalentes entre o átomo de carbono central e os átomos de cloro circundantes.
P: O tetracloreto de carbono é iônico ou covalente?
R: O tetraclorometano é um composto covalente porque forma ligações compartilhando elétrons entre os átomos de carbono e cloro.
P: Quantos átomos de cloro existem na molécula de tetracloreto de carbono?
R: Existem quatro átomos de cloro na molécula de tetraclorometano.
P: Para cada soluto, identifique o melhor solvente: água ou tetracloreto de carbono?
R: O melhor solvente depende do soluto. A água é geralmente um solvente melhor para substâncias polares, enquanto o tetraclorometano é melhor para substâncias não polares.
P: Estrutura de Lewis do tetraclorometano?
R: Na estrutura de Lewis do tetraclorometano, o átomo de carbono central está ligado a quatro átomos de cloro, sem pares solitários no átomo de carbono central.
