O tribrometo de boro (BBr3) é um composto químico usado como catalisador em diversas reações. Consiste em um átomo de boro e três átomos de bromo.
| Nome IUPAC | Tribrometo de boro |
| Fórmula molecular | BBr3 |
| Número CAS | 10294-33-4 |
| Sinônimos | Tribromoborano; Brometo de boro; Brometo de boro(III); Bromobóreo; Tribrometo de boro, [B(Br)3]; Tribromo-borano |
| InChI | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Propriedades do tribrometo de boro
Fórmula de Tribrometo de Boro
A fórmula do brometo de boro é BBr3. Consiste em um átomo de boro e três átomos de bromo. Este composto químico é formado pela combinação de boro e bromo.
Massa molar de tribrometo de boro
A massa molar do brometo de boro (BBr3) pode ser calculada adicionando as massas atômicas do boro e três átomos de bromo. O boro tem uma massa atômica de aproximadamente 10,81 gramas por mol e o bromo tem uma massa atômica de aproximadamente 79,90 gramas por mol. Portanto, a massa molar do BBr3 é aproximadamente 250,60 gramas por mol.
Ponto de ebulição do tribrometo de boro
O brometo de boro tem um ponto de ebulição relativamente baixo. Começa a ferver por volta de 91 graus Celsius (196 graus Fahrenheit). Nessa temperatura, o composto sofre uma mudança de fase de líquido para gás, liberando vapores de BBr3.
Ponto de fusão de tribrometo de boro
O ponto de fusão do brometo de boro é relativamente alto. Começa a derreter por volta de -46 graus Celsius (-51 graus Fahrenheit). A esta temperatura, o composto sólido passa para o estado líquido.
Densidade de tribrometo de boro g/mL
O brometo de boro tem uma densidade de aproximadamente 2,63 gramas por mililitro (g/mL). Esta densidade indica a massa de BBr3 presente em um mililitro do composto. É uma medida da compactação ou concentração da substância.
Peso molecular do tribrometo de boro
O peso molecular do brometo de boro (BBr3) é calculado adicionando as massas atômicas do boro e três átomos de bromo. O peso molecular do BBr3 é de aproximadamente 250,60 gramas por mol.
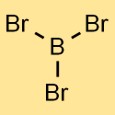
Estrutura do tribrometo de boro
A estrutura do brometo de boro consiste em um átomo de boro ligado a três átomos de bromo. O arranjo forma uma geometria trigonal planar, onde o átomo de boro está no centro e os três átomos de bromo estão distribuídos uniformemente ao seu redor.
Solubilidade do tribrometo de boro
O brometo de boro é um composto muito reativo e geralmente pouco solúvel em água. Tende a reagir com a água para formar ácido bromídrico e ácido bórico. No entanto, o BBr3 é solúvel em solventes orgânicos como clorofórmio, tetracloreto de carbono e dissulfeto de carbono.
| Aparência | Líquido incolor |
| Gravidade Específica | 2,63 g/ml |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 250,60 g/mol |
| Densidade | 2,63 g/ml |
| Ponto de fusão | -46ºC |
| Ponto de ebulição | 91°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage |
| Solubilidade | Solúvel em solventes orgânicos como clorofórmio, CCl4 e dissulfeto de carbono |
| Pressão de vapor | 78mmHg |
| Densidade do vapor | 6,52 (ar = 1) |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do tribrometo de boro
O brometo de boro apresenta alguns riscos de segurança e deve-se tomar cuidado ao manusear este composto. É corrosivo para a pele, olhos e sistema respiratório. O contato direto pode causar queimaduras e irritação grave. A inalação dos seus vapores pode causar desconforto respiratório. Reage vigorosamente com a água, emitindo vapores tóxicos. Portanto, deve ser manuseado em área bem ventilada e devem ser usados equipamentos de proteção individual adequados, como luvas e óculos de proteção. Deve ser armazenado longe de umidade e substâncias incompatíveis. Se exposto, é necessária atenção médica imediata. Protocolos e diretrizes de segurança adequados devem ser seguidos para minimizar os riscos associados ao brometo de boro.
| Símbolos de perigo | Corrosivo, perigoso quando molhado |
| Descrição de segurança | Evite contato com a pele, olhos e roupas. Usar em uma área bem ventilada. Use luvas e óculos de proteção. |
| Números de identificação da ONU | UN3264 |
| Código SH | 2811.19.9000 |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
| Toxicidade | Tóxico por inalação e ingestão; Causa queimaduras na pele e lesões oculares graves. |
Métodos para a síntese de tribrometo de boro
O brometo de boro pode ser sintetizado por vários métodos. Um método comum envolve a reação entre óxido de boro (B2O3) e bromo (Br2). A reação ocorre na presença de um catalisador, como carbono ou alumínio, a temperaturas elevadas. A reação resultante produz brometo de boro e libera gás oxigênio.
Outro método envolve a reação entre tricloreto de boro (BCl3) e bromo. Esta reação ocorre à temperatura ambiente e forma brometo de boro e cloro gasoso como subprodutos.
Para preparar o brometo de boro, o boro pode reagir com excesso de bromo em um ambiente controlado, exigindo altas temperaturas e controle cuidadoso das condições de reação.
Outro método é sintetizar o brometo de boro pela reação de hidretos de boro, como diborano (B2H6) ou borano (BH3), com brometo de hidrogênio (HBr). Esta reação produz brometo de boro e gás hidrogênio como produtos.
Tenha em mente que estes métodos de síntese requerem cautela devido à natureza altamente reativa do brometo de boro. Protocolos de segurança adequados, como usar equipamentos de proteção adequados e trabalhar em uma área bem ventilada, devem ser seguidos durante o processo de síntese.
Usos do tribrometo de boro
O brometo de boro (BBr3) tem vários usos importantes em diversas indústrias. Aqui estão algumas aplicações principais:
- Catalisador: BBr3 catalisa ativamente reações de síntese orgânica, possibilitando processos como reações de acilação, alquilação e halogenação.
- Intermediários químicos: O BBr3 atua como precursor na produção de outros compostos de boro, sintetizando reagentes contendo boro, ácidos borônicos e polímeros à base de boro.
- Polimerização: O BBr3 participa ativamente das reações de polimerização, principalmente na produção de polímeros como polietileno e polipropileno, servindo como catalisador ácido de Lewis.
- Agente dopante: A indústria de semicondutores utiliza ativamente o BBr3 como agente dopante, modificando as propriedades elétricas do silício para adequação em dispositivos eletrônicos.
- Detecção de gás: O BBr3 reage ativamente com gases específicos como a amônia, tornando-o adequado para detectores de gás e sensores usados para fins de detecção e monitoramento.
- Reagente de Laboratório: O BBr3 atua ativamente como reagente em diversos experimentos e pesquisas laboratoriais, realizando reações de bromação e atuando como fonte de átomos de bromo na química sintética.
- Síntese farmacêutica: A indústria farmacêutica utiliza ativamente o BBr3 na síntese de certos medicamentos e intermediários farmacêuticos.
É importante manusear o brometo de boro com cuidado, seguindo os protocolos de segurança adequados, devido à sua natureza corrosiva e reativa.
Questões:
P: Qual termo descreve a reatividade do tribrometo de boro (BBr3)?
R: Muito responsivo.
P: Qual é a fórmula do tribrometo de boro?
R: A fórmula do brometo de boro é BBr3.
P: Quantos átomos de boro existem em 3,24 gramas de tribrometo de boro?
R: Existem 0,053 moles de BBr3 em 3,24 gramas, o que corresponde a 0,159 moles de boro, ou aproximadamente 9,62 x 10 ^ 22 átomos.
P: Quantos gramas de tribrometo de boro podem ser produzidos a partir de 3,49 gramas de bromo?
R: A massa molar do BBr3 é 250,60 g/mol. Assim, cerca de 3,49 gramas de bromo podem produzir cerca de 3,34 gramas de brometo de boro.
P: Qual é o nome do composto com a fórmula BBr3?
R: O composto com a fórmula BBr3 é denominado brometo de boro.
P: O tribrometo de boro é polar ou apolar?
R: O brometo de boro é um composto polar.
P: Qual é a geometria eletrônica do BBr3?
R: A geometria eletrônica do BBr3 é trigonal planar.
P: Qual é a estrutura de Lewis para BBr3?
R: Na estrutura de Lewis do BBr3, há um átomo de boro no centro rodeado por três átomos de bromo.
P: Quantos picos no BBr3?
A: O brometo de boro (BBr3) tem um pico em seu espectro de RMN.
