O tricloreto de boro (BCl3) é um composto que compreende três átomos de cloro ligados a um átomo de boro. É utilizado em diversos processos industriais, como catalisadores e como reagente em síntese orgânica.
| Nome IUPAC | Tricloreto de boro |
| Fórmula molecular | BCl3 |
| Número CAS | 10294-34-5 |
| Sinônimos | Tricloroborano; Cloreto de boro (III), tricloroborano, tricloroboro |
| InChI | InChI=1S/BCl3/c2-1(3)4 |
Propriedades do tricloreto de boro
Fórmula de tricloreto de boro
A fórmula do cloreto de boro é BCl3, representando um átomo de boro ligado a três átomos de cloro. Esta é uma fórmula molecular simples e direta que descreve a composição deste composto.
Massa molar de tricloreto de boro
A massa molar do cloreto de boro pode ser calculada somando as massas atômicas de seus elementos constituintes. O boro tem uma massa atômica de aproximadamente 10,81 gramas por mol e cada átomo de cloro tem uma massa atômica de aproximadamente 35,45 gramas por mol. Portanto, a massa molar do BCl3 é de aproximadamente 117,17 gramas por mol.
Ponto de ebulição do tricloreto de boro
O cloreto de boro tem um ponto de ebulição relativamente baixo em comparação com muitos outros compostos. Ferve a cerca de -15,7 graus Celsius ou 3,77 graus Fahrenheit. Isto significa que a temperaturas acima deste ponto, o cloreto de boro muda de uma fase líquida para uma fase gasosa.
Ponto de fusão de tricloreto de boro
O ponto de fusão do cloreto de boro é relativamente baixo. Ele derrete a cerca de -107,5 graus Celsius ou -161,5 graus Fahrenheit. Em temperaturas abaixo deste ponto, o composto muda do estado sólido para o estado líquido.
Densidade de tricloreto de boro g/mL
A densidade do cloreto de boro é de aproximadamente 1,38 gramas por mililitro. Este valor indica a massa do composto por unidade de volume. É útil para determinar o comportamento do cloreto de boro em diversas aplicações e compreender suas propriedades físicas.
Peso molecular do tricloreto de boro
O peso molecular do cloreto de boro é de aproximadamente 117,17 gramas por mol. Este valor representa a soma das massas atômicas de todos os átomos de uma molécula do composto e é útil para diversos cálculos, como determinar a quantidade de cloreto de boro em uma determinada amostra.
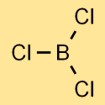
Estrutura do tricloreto de boro
O cloreto de boro tem uma estrutura molecular trigonal planar. Consiste em um átomo de boro no centro ligado a três átomos de cloro, dispostos em formato triangular. Esta estrutura contribui para as propriedades físicas e químicas do composto.
Solubilidade do tricloreto de boro
O cloreto de boro tem baixa solubilidade em água. É pouco solúvel, o que significa que se dissolve apenas até certo ponto em soluções aquosas. No entanto, é mais solúvel em solventes orgânicos como benzeno e tetracloreto de carbono. A solubilidade do cloreto de boro influencia seu comportamento em diferentes reações químicas e processos industriais.
| Aparência | Gás incolor |
| Gravidade Específica | 1.369g/mL |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 117,17 g/mol |
| Densidade | 1,38g/ml |
| Ponto de fusão | -107,5ºC |
| Ponto de ebulição | -15,7ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage |
| Solubilidade | Solúvel em solventes orgânicos como benzeno e tetracloreto de carbono |
| Pressão de vapor | 623 mmHg a 20°C |
| Densidade do vapor | 3,24 (ar = 1) |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do tricloreto de boro
O cloreto de boro levanta várias considerações de segurança e perigo. É corrosivo e pode causar queimaduras graves na pele, olhos e trato respiratório em contato. A inalação de seus vapores pode causar irritação respiratória e danos aos pulmões. O composto também é muito reativo com água, liberando gás tóxico cloreto de hidrogênio. É essencial manusear o cloreto de boro com cautela, utilizando equipamento de proteção individual adequado e garantindo ventilação adequada. Em caso de exposição acidental, é necessária atenção médica imediata. Além disso, procedimentos adequados de armazenamento e manuseio devem ser seguidos para evitar o risco de incêndio, explosão e liberação de gases perigosos.
| Símbolos de perigo | Corrosivo (C) |
| Descrição de segurança | Use luvas de proteção/proteção ocular/proteção facial. Não respirar poeiras/fumos/gases/névoas/vapores/aerossóis. Manuseie em uma área bem ventilada. |
| Números de identificação da ONU | ONU1741 |
| Código SH | 2827390000 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico por ingestão ou inalação. Pode causar queimaduras graves e irritação respiratória. Manuseie com extremo cuidado. |
Métodos para a síntese de tricloreto de boro
Um método para sintetizar cloreto de boro envolve a reação entre óxido de boro (B2O3 ) e tetracloreto de carbono (CCl4) na presença de um catalisador como cloreto de alumínio (AlCl3) . B2O3 e CCl4 reagem em altas temperaturas, produzindo cloreto de boro e dióxido de carbono como subprodutos.
Outra abordagem é a reação direta entre o boro e o gás cloro. Sob condições controladas, o boro reage com o cloro, resultando na formação de cloreto de boro. Este método requer um manuseio cuidadoso do gás cloro devido à sua natureza perigosa.
O cloreto de tionila (SOCl2) permite a síntese de cloreto de boro pela reação do boro com SOCl2 em temperaturas elevadas, resultando na produção de cloreto de boro e gás dióxido de enxofre.
Esses métodos de síntese oferecem rotas viáveis para a fabricação de cloreto de boro, tanto em laboratório quanto em ambientes industriais. É crucial garantir medidas de segurança adequadas durante a síntese, como trabalhar em áreas bem ventiladas e utilizar equipamentos de proteção adequados. Isto é importante devido à natureza perigosa dos reagentes e produtos envolvidos no processo.
Escreva os usos do tricloreto de boro
O cloreto de boro é amplamente utilizado em catálise, fabricação de semicondutores, síntese de materiais e várias outras indústrias devido às suas propriedades químicas únicas e versatilidade.
- O cloreto de boro (BCl3) encontra aplicação como catalisador em diversas reações químicas, principalmente na síntese orgânica. Facilita a formação de ligações carbono-carbono e carbono-heteroátomo na produção de produtos farmacêuticos, agroquímicos e produtos químicos finos.
- BCl3 serve como reagente na síntese de polímeros à base de boro, como o poliborazileno, que têm aplicações em revestimentos retardadores de chama e de alta temperatura.
- O BCl3 facilita a produção de nitreto de boro, um material conhecido pela sua excepcional estabilidade térmica e química, amplamente utilizado em aplicações de alta temperatura e como lubrificante.
- A indústria de semicondutores utiliza BCl3 como dopante para incorporar átomos de boro em cristais de silício, melhorando suas propriedades elétricas e tornando-os adequados para uso em dispositivos eletrônicos.
- Na metalurgia, o BCl3 atua como agente fundente para remover impurezas de óxido durante o refino de metais, melhorando assim sua pureza.
- O BCl3 desempenha um papel central na fabricação de carboneto de boro, um material leve e resistente amplamente utilizado na produção de armaduras cerâmicas e ferramentas de corte.
- BCl3 desempenha um papel crucial na síntese de muitos compostos contendo boro, incluindo ésteres de boro, ácidos borônicos e boranos. Esses compostos têm muitas aplicações em pesquisas químicas e processos industriais.
- Na indústria do petróleo, o BCl3 é utilizado como aditivo para aumentar o índice de octanas da gasolina.
Serve como fonte de boro na produção de vidro contendo boro, que possui propriedades ópticas e térmicas desejáveis.
Questões:
P: Qual é a fórmula do tricloreto de boro?
R: A fórmula do cloreto de boro é BCl3.
P: O tricloreto de boro é polar?
R: Sim, o cloreto de boro é uma molécula polar devido à presença de um dupleto livre no átomo de boro e ao arranjo assimétrico dos átomos de cloro.
P: O que é hibridização de boro em tricloreto de boro (BCl3)?
R: A hibridização de boro em BCl3 é sp2.
P: Qual é a massa de uma molécula de tricloreto de boro?
R: A massa de uma molécula de cloreto de boro (BCl3) é de aproximadamente 117,17 gramas por mol.
P: O que é hibridização com tricloreto de boro?
R: A hibridização de boro em cloreto de boro (BCl3) é sp2.
P: O que acontece quando você mistura tricloreto de boro e hidrogênio?
R: Quando o cloreto de boro (BCl3) é misturado com hidrogênio (H2), eles reagem para formar gás boro e cloreto de hidrogênio (HCl).
P: Por que o tricloreto de boro existe como monômero enquanto o tricloreto de alumínio existe como dímero?
R: A diferença de tamanho e densidade eletrônica entre os átomos de boro e alumínio faz com que o cloreto de boro (BCl3) exista como um monômero, enquanto o cloreto de alumínio (AlCl3) forma um dímero devido à sua capacidade de formar ligações coordenadas.
P: BCl3 é um ácido de Lewis?
R: Sim, BCl3 é um ácido de Lewis porque pode aceitar um par de elétrons de uma base de Lewis.
P: O BCl3 é iônico ou covalente?
R: BCl3 é um composto covalente.
P: BCl3 é uma ligação covalente?
R: Sim, BCl3 é composto de ligações covalentes entre átomos de boro e cloro.
P: BCl3 é um gás?
R: Sim, BCl3 é um gás padrão de temperatura e pressão (STP).
P: O BCl3 é uma molécula polar ou apolar?
R: BCl3 é uma molécula polar devido à distribuição desigual da densidade eletrônica causada pelo arranjo assimétrico dos átomos de cloro em torno do átomo de boro.
