O óxido de boro (B2O3) é um composto formado pela ligação química do boro e do oxigênio. É utilizado na produção de vidro e cerâmica devido ao seu alto ponto de fusão.
| Nome IUPAC | Óxido de boro |
| Fórmula molecular | B2O3 |
| Número CAS | 1303-86-2 |
| Sinônimos | Trióxido de triboro, óxido bórico, óxido de boro (III) |
| InChI | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
Propriedades do óxido de boro
Fórmula de Óxido de Boro
A fórmula química do óxido bórico é B2O3. Representa a proporção entre átomos de boro e átomos de oxigênio no composto. Os números de índice indicam que existem dois átomos de boro e três átomos de oxigênio presentes em cada molécula de óxido bórico.
Massa molar de óxido de boro
A massa molar do óxido bórico pode ser calculada somando as massas atômicas de seus elementos constituintes. O boro tem massa atômica de 10,81 g/mol, enquanto o oxigênio tem massa atômica de 16,00 g/mol. Multiplicando as massas atômicas pelo respectivo número de átomos e somando-as, a massa molar do óxido bórico é determinada como 69,62 g/mol.
Ponto de ebulição do óxido de boro
O óxido bórico tem um alto ponto de ebulição de cerca de 1.860 graus Celsius. Isso significa que, à pressão atmosférica normal, é necessária uma energia significativa para converter o óxido bórico do estado líquido para o estado gasoso.
Ponto de fusão do óxido de boro
O ponto de fusão do óxido bórico é de cerca de 450 graus Celsius. A esta temperatura, o óxido bórico sólido muda para o estado líquido. Seu ponto de fusão relativamente baixo o torna adequado para diversas aplicações industriais.
Densidade de óxido de boro g/mL
O óxido bórico tem uma densidade de aproximadamente 2,46 g/mL. Densidade refere-se à massa por unidade de volume de uma substância. A densidade do óxido bórico indica que ele é relativamente denso, permitindo fluir na maioria dos líquidos.
Peso molecular do óxido de boro
O peso molecular do óxido bórico, também chamado de massa molar, é 69,62 g/mol. Este valor representa a massa de um mol do composto e é útil para calcular a quantidade de óxido bórico em uma determinada amostra.
Estrutura do óxido de boro
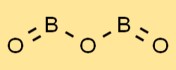
O óxido bórico tem uma estrutura única, apresentando uma série de unidades trigonais planares de BO3. Os átomos de boro são cercados por três átomos de oxigênio dispostos triangularmente. Este arranjo confere ao óxido bórico suas propriedades e estabilidade características.
Solubilidade do óxido de boro
O óxido bórico é insolúvel em água e na maioria dos solventes orgânicos. Sua solubilidade é limitada em ácidos como ácido sulfúrico e ácido clorídrico. Essa baixa solubilidade contribui para sua estabilidade e utilidade em diversas aplicações, como produção de vidro e cerâmica.
| Aparência | Sólido branco |
| Gravidade Específica | 2,46g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 69,62 g/mol |
| Densidade | 2,46g/ml |
| Ponto de fusão | 450ºC |
| Ponto de ebulição | 1860°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solubilidade limitada em ácidos, como ácido sulfúrico e ácido clorídrico |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Observe que algumas propriedades como ponto de fulgor, pressão de vapor, densidade de vapor, pKa e pH não são aplicáveis ou não foram relatadas para o óxido bórico.
Segurança e perigos do óxido de boro
O óxido bórico apresenta certas considerações de segurança e perigo. O contato direto com pó ou poeira de óxido bórico pode irritar a pele, os olhos e o sistema respiratório. É importante manuseá-lo com cuidado e utilizar equipamentos de proteção individual adequados, como luvas e óculos de proteção. A inalação de partículas de óxido bórico pode causar irritação respiratória, por isso é aconselhável trabalhar em áreas bem ventiladas. Em caso de ingestão acidental deve-se procurar atendimento médico imediatamente. O óxido bórico não é inflamável e não possui ponto de inflamação. Tal como acontece com qualquer substância química, recomenda-se que sejam seguidas as orientações adequadas de manuseamento e armazenamento para garantir uma utilização segura.
| Símbolos de perigo | Não classificado |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Usar em uma área bem ventilada. Use equipamento de proteção. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2810.00.2000 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Toxicidade baixa a moderada. Pode causar irritação por contato ou inalação. |
Observe que o óxido bórico não possui símbolos de perigo, identificação da ONU, classe de perigo ou grupo de embalagem. É importante seguir as diretrizes e práticas gerais de segurança ao manusear e usar óxido bórico para minimizar o risco de exposição e garantir o uso seguro.
Métodos para a síntese de óxido de boro
Vários métodos permitem a síntese de óxido bórico. Uma abordagem amplamente utilizada é aquecer o boro elementar na presença de oxigênio ou ar para criar óxido bórico. Outro método envolve a reação de halogenetos de boro, como tricloreto de boro (BCl3) ou tribrometo de boro (BBr3), com água, resultando na formação de óxido bórico.
Além disso, compostos contendo boro, como nitreto de boro ou trissulfeto de boro, podem sofrer hidrólise com água para produzir óxido bórico. A decomposição térmica de boratos, como borato de sódio ou bórax , quando submetidos ao calor também produz óxido bórico.
É importante ressaltar que a escolha de um método de síntese específico depende da pureza, quantidade e aplicação desejada do óxido bórico. Cada método tem vantagens e pode ser adequado para diferentes situações.
Usos do óxido de boro
O óxido bórico encontra diversas aplicações em diversas indústrias. Aqui estão alguns de seus usos:
- Produção de vidro e cerâmica: O óxido bórico é um ingrediente chave na fabricação de vidro e cerâmica. Confere aos produtos de vidro propriedades desejáveis, como resistência ao calor, transparência e durabilidade.
- Retardadores de chama: Os fabricantes usam óxido bórico como retardador de chama em materiais como têxteis, plásticos e produtos de madeira. O óxido bórico reduz a inflamabilidade destes materiais, garantindo maior segurança.
- Vidro Borossilicato: O óxido bórico desempenha um papel vital como componente do vidro borossilicato, conhecido por sua baixa expansão térmica e alta resistência ao calor. As indústrias usam esse tipo de vidro em equipamentos de laboratório, utensílios de cozinha e dispositivos ópticos de última geração.
- Fibras especiais: A produção de fibras especiais, incluindo fibras de boro e fibras de nitreto de boro, incorpora o uso de óxido bórico. Estas fibras possuem propriedades mecânicas e térmicas excepcionais, tornando-as adequadas para as indústrias aeroespacial, automotiva e de alta tecnologia.
- Produtos químicos de boro: O óxido bórico serve como precursor para a síntese de vários produtos químicos de boro, como boratos e hidretos de boro. Esses produtos químicos encontram aplicações na agricultura, produtos farmacêuticos e sistemas de armazenamento de energia.
- Fundentes e Agentes de Soldagem: O óxido bórico reduz o ponto de fusão dos materiais e melhora sua fluidez, tornando-o um fundente eficaz em processos metalúrgicos. Melhora a ligação de superfícies metálicas quando usado como agente de solda.
- Catalisadores: As reações químicas se beneficiam dos catalisadores de óxido bórico porque promovem reações desejáveis e aumentam as taxas de reação.
- Indústria de Semicondutores: O óxido bórico desempenha um papel crucial na produção de semicondutores. Ele atua como um material dopante para modificar ativamente as propriedades elétricas do silício.
A ampla gama de aplicações do óxido bórico destaca sua versatilidade e importância em diversas indústrias, contribuindo para avanços em tecnologia, segurança e ciência de materiais.
Questões:
P: Qual é o estado de oxidação do boro no B2O3?
R: O estado de oxidação do boro em B2O3 é +3.
P: Qual é a fórmula empírica do óxido de boro?
R: A fórmula empírica do óxido bórico é B2O3.
P: Quando a concentração superficial de boro afetará a taxa de crescimento do óxido?
R: A concentração superficial de boro afetará a taxa de crescimento do óxido quando ele atua como dopante ou catalisador no processo de oxidação.
P: O que é Óxido de Boro Boria?
R: O óxido bórico, também conhecido como boria, é um composto com a fórmula química B2O3.
P: Qual é o número de oxidação do boro?
R: O boro geralmente tem um número de oxidação de +3.
P: O boro retardará a oxidação em materiais privados de oxigênio?
R: O boro não retarda a oxidação em materiais privados de oxigênio porque requer oxigênio para formar óxido bórico.
P: Qual é o estado de oxidação do boro no HBO2 em CuO?
R: O estado de oxidação do boro no HBO2 é +3.
P: Quantos mols de B2O3 podem ser formados?
R: O número de moles de B2O3 formados depende da quantidade de reagentes utilizados na reação.
P: O B2O3 é iônico ou molecular?
R: B2O3 é um composto iônico.
P: Qual par está listado em ordem crescente de basicidade? PBO <SiO2 B2O3 <Li2O
R: O par listado em ordem crescente de basicidade é B2O3 <Li2O <PBO <SiO2.
P: B2H6 + O2 → B2O3 + H2O, esta equação está balanceada?
R: Não, a equação não está balanceada. Isso requer ajustes para alcançar uma equação equilibrada.
P: Quanto boro você pode obter com 210,0 libras de B2O3?
R: A quantidade de boro obtida a partir de 210,0 libras de B2O3 depende da massa molar e da estequiometria da reação.
