O sulfato de prata (Ag2SO4) é um sólido branco usado em fotografia e química analítica. Dissolve-se em água e, quando aquecido, decompõe-se em óxido de prata e trióxido de enxofre.
| Nome IUPAC | Sulfato de prata |
| Fórmula molecular | Ag2SO4 |
| Número CAS | 10294-26-5 |
| Sinônimos | Sulfato de prata, sulfato de prata, ácido sulfúrico de prata, monossulfato de prata |
| InChI | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriedades do sulfato de prata
Fórmula de sulfato de prata
A fórmula química do sulfato diargente é Ag2SO4. Consiste em dois átomos de prata (Ag) ligados a um átomo de enxofre (S) e quatro átomos de oxigênio (O). A fórmula representa a proporção de átomos em uma molécula de sulfato diargente.
Massa molar de sulfato de prata
A massa molar do sulfato de prata é calculada somando as massas atômicas de seus elementos constituintes. A prata tem massa atômica de 107,87 gramas por mol (g/mol), o enxofre tem massa atômica de 32,07 g/mol e o oxigênio tem massa atômica de 16,00 g/mol. Somando-os, a massa molar do sulfato diargente é de aproximadamente 311,81 g/mol.
Ponto de ebulição do sulfato de prata
O sulfato diargente não tem um ponto de ebulição distinto porque se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, sofre decomposição térmica e se decompõe em óxido de prata (Ag2O) e trióxido de enxofre (SO3). Portanto, o ponto de ebulição do sulfato diargente não é aplicável.
Ponto de fusão do sulfato de prata
O ponto de fusão do sulfato diargente é de aproximadamente 652 graus Celsius (1.206 graus Fahrenheit). A esta temperatura, o sulfato diargente muda do estado sólido para o estado líquido fundido. É importante notar que o ponto de fusão pode variar ligeiramente dependendo da pureza da amostra de sulfato diargente.
Densidade de sulfato de prata g/mL
A densidade do sulfato diargente é de aproximadamente 5,45 gramas por mililitro (g/mL). Este valor indica a massa de sulfato diargente por unidade de volume. A densidade de uma substância geralmente depende da temperatura, por isso é importante considerar as condições ao medir a densidade do sulfato diargente.
Peso Molecular do Sulfato de Prata
O peso molecular do sulfato diargente é calculado somando os pesos atômicos de seus elementos constituintes, levando em consideração a estequiometria da fórmula. No caso do sulfato de disprata (Ag2SO4), o peso molecular é de aproximadamente 311,81 gramas por mol (g/mol).
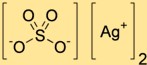
Estrutura do sulfato de prata
O sulfato de disprata possui uma estrutura cristalina composta por cátions de prata (Ag+) e ânions sulfato (SO4 ^ 2-). Os cátions de prata são circundados por átomos de oxigênio dos ânions sulfato, formando uma rede tridimensional.
Solubilidade do sulfato de prata
O sulfato diargente é pouco solúvel em água. Dissolve-se até certo ponto, com cerca de 0,8 gramas dissolvendo-se em 100 mililitros de água à temperatura ambiente. A solubilidade pode ser influenciada por fatores como temperatura e presença de outros solutos na solução.
| Aparência | Sólido branco |
| Gravidade Específica | N / D |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 311,81 g/mol |
| Densidade | 5,45g/ml |
| Ponto de fusão | 652°C (1206°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | N / D |
| Solubilidade em Água | Pouco solúvel |
| Solubilidade | Dissolve-se em aq. ácidos, álcoois, acetona, éter, acetatos, amidas |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | N / D |
Segurança e perigos do sulfato de prata
O sulfato diargente apresenta alguns riscos de segurança e deve-se tomar cuidado ao manuseá-lo. É importante evitar a inalação, ingestão ou contato com a pele e os olhos. Ao manusear o sulfato diargente, é aconselhável usar equipamento de proteção individual adequado, incluindo luvas, óculos de proteção e jaleco. Em caso de exposição acidental, lavar abundantemente as áreas afetadas com água. O sulfato diargente pode causar irritação na pele e nos olhos, e a exposição prolongada ou repetida pode causar sensibilização. Também é necessário manusear o sulfato diargente em uma área bem ventilada para minimizar o risco de inalação. Procedimentos adequados de armazenamento, rotulagem e descarte devem ser seguidos para garantir a segurança.
| Símbolos de perigo | Nenhum símbolo |
| Descrição de segurança | Evite inalação, ingestão e contato com a pele e os olhos. Use EPI. Manuseie em uma área bem ventilada. Armazenamento, rotulagem e descarte adequados. |
| Números de identificação da ONU | N / D |
| Código SH | 28429090 |
| Classe de perigo | N / D |
| Grupo de embalagem | N / D |
| Toxicidade | Irritante para a pele e os olhos. A exposição prolongada/repetida pode causar sensibilização. |
Métodos para a síntese de sulfato de prata
Existem vários métodos para sintetizar sulfato diargente.
Um método comum envolve a reação entre nitrato de prata (AgNO3) e ácido sulfúrico (H2SO4) . No laboratório, enquanto agitam, os cientistas adicionam lentamente nitrato de prata a uma solução de ácido sulfúrico, resultando na formação de um precipitado branco chamado sulfato diargente. Eles coletam o precipitado, lavam e secam para obter sulfato diargente puro.
Os cientistas também obtêm sulfato de prata adicionando óxido de prata (Ag2O) ao ácido sulfúrico e aquecendo a mistura enquanto mexe. Este processo produz sulfato diargente como precipitado, que filtram, lavam e secam para obter o produto final.
Além disso, os cientistas podem obter sulfato de prata aquecendo uma mistura de cloreto de prata (AgCl) e ácido sulfúrico concentrado. Eles adicionam cloreto de prata ao ácido sulfúrico e aplicam calor à mistura. A reação leva à formação de sulfato de prata na forma de precipitado, que pode ser coletado, lavado e seco.
É importante notar que estes métodos de síntese devem ser realizados com as devidas precauções de segurança, incluindo a utilização de equipamento de proteção adequado e o trabalho numa área bem ventilada.
Usos do sulfato de prata
O sulfato de disprata tem diversos usos em diferentes campos devido às suas propriedades únicas. Aqui estão algumas de suas aplicações comuns:
- Fotografia: Na fotografia em preto e branco, os fotógrafos usam sulfato diargente como componente de emulsões fotossensíveis para capturar e revelar imagens reagindo com a luz.
- Química Analítica: Vários métodos analíticos utilizam sulfato de prata como reagente para detectar e quantificar haletos, como íons cloreto e brometo, por meio de reações de precipitação.
- Galvanoplastia: Os processos de galvanoplastia usam sulfato diargente para depositar uma camada de prata em superfícies condutoras, criando revestimentos decorativos ou protetores em joias, dispositivos eletrônicos e outros objetos.
- Agente Antimicrobiano: Devido às suas propriedades antimicrobianas, o sulfato diargente encontra aplicação na formulação de curativos, pomadas e dispositivos médicos. Ajuda a prevenir infecções e promove a cura.
- Indústria de baterias: A indústria de baterias utiliza-o como um componente crucial no material de eletrodos para a fabricação de baterias de prata-zinco e prata-cádmio, que são predominantes em dispositivos eletrônicos e equipamentos médicos.
- Reagente de Laboratório: O sulfato de disprata é usado como reagente em uma variedade de experimentos de laboratório, incluindo a síntese de outros compostos de prata e em reações de química orgânica.
- Fabricação de vidro: Na fabricação de vidro, desempenha um papel vital na produção de vidros especiais, incluindo espelhos prateados e revestimentos de janelas condutores. Os fabricantes aplicam uma fina camada de sulfato diargente para atingir as propriedades desejadas.
- Catalisador: O sulfato de disprata atua como catalisador em certas reações químicas, incluindo reações de oxidação e processos de polimerização.
Questões:
P: O que mais é produzido na reação de substituição do nitrato de prata e do sulfato de potássio?
R: Na reação de substituição de AgNO3 e K2SO4, os produtos formados são nitrato de potássio (KNO3) e sulfato diargente (Ag2SO4).
P: Se mais sulfato de prata sólido for adicionado à solução, ele se dissolverá?
R: Sim, o sulfato de prata sólido adicional se dissolverá na solução, pois é pouco solúvel em água.
P: A precipitação ocorre quando nitrato de prata + sulfato de sódio?
R: Sim, a precipitação ocorre quando o AgNO3 reage com o sulfato de sódio, resultando na formação de um precipitado sólido de Ag2SO4.
P: Qual é a porcentagem de prata no sulfato de prata?
R: A porcentagem de Ag no sulfato diargente é de aproximadamente 63,48%.
P: O sulfato de prata é solúvel ou insolúvel?
R: O sulfato diargente é pouco solúvel em água.
P: Como encontrar a fórmula química do sulfato de prata?
R: A fórmula química do sulfato de prata é Ag2SO4, que pode ser determinada com base na valência do cátion Ag+ e do ânion SO4-2.
P: Qual é a cor do Ag2SO4?
R: O sulfato de disprata (Ag2SO4) é um sólido branco.
P: Qual é o valor Ksp para Ag2SO4 se 5,49 g são solúveis em 1,00 L de água?
R: O valor da constante do produto de solubilidade (Ksp) para Ag2SO4 pode ser calculado usando as informações fornecidas, mas isso requer dados adicionais sobre a dissociação de Ag2SO4 em água.
P: Qual é a massa molar do Ag2SO4?
R: A massa molar de Ag2SO4 é aproximadamente 311,81 g/mol.
P: Um Ag2SO4 sólido é formado quando 2,7g são dissolvidos em 100ml de água?
R: Sim, algum Ag2SO4 sólido pode se formar quando excede o limite de solubilidade do sulfato diargente em 100 ml de água.
