O ácido hidrazóico (HN3) é um composto altamente volátil. É incolor e tem um odor pungente. É usado em reações químicas e pode ser tóxico e explosivo.
| Nome IUPAC | Ácido hidrazóico |
| Fórmula molecular | HN3 |
| Número CAS | 7782-79-8 |
| Sinônimos | Azoimida, hidrogenazida, ácido azótico, ácido hidronítrico, ácido triazóico |
| InChI | InChI=1S/HN3/c1-3-2/h1H |
Propriedades do ácido hidrazóico
Fórmula de ácido hidrazóico
A fórmula química do ácido hidrazóico é HN3. Consiste em um átomo de hidrogênio e três átomos de nitrogênio ligados entre si covalentemente. Esta fórmula simples representa a composição básica do composto, o que é crucial para a compreensão das suas propriedades e reações.
Massa molar de ácido hidrazóico
A massa molar da azida de hidrogênio (HN3) é de aproximadamente 43,03 gramas por mol. Este valor é obtido somando as massas atômicas de um átomo de hidrogênio (H) e três átomos de nitrogênio (N). A massa molar é essencial para o cálculo da estequiometria em reações químicas.
Ponto de ebulição do ácido hidrazóico
A azida de hidrogênio tem um ponto de ebulição relativamente baixo, cerca de 37 graus Celsius (98,6 graus Fahrenheit). Devido à sua natureza volátil, vaporiza facilmente na forma gasosa em temperaturas moderadas. É necessário extremo cuidado ao manusear este composto.
Ponto de fusão do ácido hidrazóico
O ponto de fusão da azida de hidrogênio é de cerca de -80 graus Celsius (-112 graus Fahrenheit). A esta temperatura, o composto sólido muda para a forma líquida. Por ser muito reativo, seu estado sólido requer armazenamento e manuseio adequados.
Densidade de ácido hidrazóico g/mL
A densidade da azida de hidrogénio é de aproximadamente 1,09 gramas por mililitro. Este valor indica sua massa por unidade de volume, refletindo sua compactação e concentração em um determinado espaço. É um parâmetro crítico para medições laboratoriais.
Peso molecular do ácido hidrazóico
O peso molecular da azida de hidrogênio (HN3) é 43,03 gramas por mol. É a soma dos pesos atômicos dos elementos presentes em uma única molécula do composto. O peso molecular desempenha um papel vital na determinação de seu comportamento físico e químico.
Estrutura do ácido hidrazóico
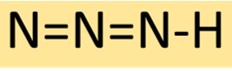
A azida de hidrogênio tem uma estrutura molecular linear, consistindo de três átomos de nitrogênio ligados em sequência com um único átomo de hidrogênio no final. Este arranjo resulta em um composto estável, mas altamente reativo, frequentemente utilizado em síntese química.
Solubilidade do ácido hidrazóico
A azida de hidrogênio tem solubilidade limitada em água, tornando-a um composto pouco solúvel. Pode dissolver-se em pequena extensão em soluções aquosas, mas a sua baixa solubilidade limita a sua utilização em algumas aplicações. Cuidados especiais são necessários ao lidar com sua forma aquosa devido à sua natureza tóxica e explosiva.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,09g/ml |
| Cor | Incolor |
| Cheiro | Cheiro forte |
| Massa molar | 43,03 g/mol |
| Densidade | 1,09g/ml |
| Ponto de fusão | -80°C (-112°F) |
| Ponto de ebulição | 37°C (98,6°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Ligeiramente solúvel |
| Solubilidade | Solúvel em solventes alcalinos e orgânicos, como álcool, éter |
| Pressão de vapor | 23,1 mmHg a 20°C |
| Densidade do vapor | 1,4 (ar = 1) |
| pKa | 4.6 |
| pH | Cerca de 3-4 |
Segurança e perigos do ácido hidrazóico
A azida de hidrogénio apresenta riscos de segurança significativos. É altamente tóxico e pode causar sérios efeitos à saúde se exposto. A inalação de seus vapores ou névoas pode causar irritação respiratória, tontura e até morte. O contato com a pele ou os olhos pode causar queimaduras, irritação e danos aos tecidos. O composto também é extremamente inflamável e pode formar misturas explosivas. Reage violentamente com diversas substâncias, como metais e agentes oxidantes. Devem ser seguidas medidas de segurança adequadas ao manusear a azida de hidrogénio, incluindo o uso de vestuário de protecção, utilização de ventilação adequada e armazenamento seguro para evitar acidentes ou libertações no ambiente. o ambiente.
| Símbolos de perigo | Caveira e Ossos Cruzados, Corrosivos |
| Descrição de segurança | Muito tóxico, corrosivo |
| Números de identificação da ONU | UN1687 |
| Código SH | 2811.29.10 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II (Perigo Médio) |
| Toxicidade | Muito tóxico; pode ser fatal em pequenas quantidades |
Métodos para a síntese de ácido hidrazóico
Vários métodos permitem a síntese de azida de hidrogénio.
Uma abordagem comum envolve a reação entre azida de sódio (NaN3) e um ácido, como ácido sulfúrico (H2SO4) ou ácido clorídrico (HCl) . Neste método, o ácido se mistura com a azida de sódio, resultando na formação de azida de hidrogênio e do sal correspondente do ácido utilizado.
Outro método envolve a reação entre azida de sódio e um halogeneto de alquila, como iodeto de metila (CH3I) ou iodeto de etila (C2H5I). Esta reação, conhecida como rearranjo de Curtius, resulta na formação de azida de hidrogênio como produto.
A reação entre azida de sódio e ácido nitroso (HNO2) produz azida de hidrogênio. Para gerar ácido nitroso in situ, o nitrito de sódio (NaNO2) é normalmente adicionado a uma solução ácida. A reação entre azida de sódio e ácido nitroso produz azida de hidrogênio.
É importante notar que a síntese da azida de hidrogénio requer um manuseamento cuidadoso e medidas de segurança adequadas. Devido à sua toxicidade e natureza explosiva, as reações devem ser conduzidas em área bem ventilada, utilizando equipamentos de proteção adequados e seguindo os protocolos estabelecidos.
Cada método de síntese tem suas vantagens e limitações, e a escolha do método depende de fatores como disponibilidade de reagentes, rendimento desejado e considerações de segurança. Uma boa compreensão e experiência no manuseamento de produtos químicos perigosos são essenciais para conduzir estas sínteses de forma eficiente e segura.
Usos do ácido hidrazóico
A azida de hidrogênio encontra aplicações em vários campos devido às suas propriedades únicas. Aqui estão alguns de seus usos:
- Reagente Químico: A azida de hidrogênio serve como um reagente químico versátil na síntese orgânica, participando ativamente de muitas reações, incluindo a síntese de azidas, que são blocos de construção cruciais em produtos farmacêuticos e corantes.
- Detonadores e propelentes: Os fabricantes utilizam azida de hidrogênio para a produção de detonadores e propulsores utilizados em airbags e dispositivos de segurança, beneficiando-se de sua natureza explosiva e rápida decomposição, que libera ativamente gás nitrogênio, o que a torna valiosa nessas aplicações.
- Análise Laboratorial: A química analítica utiliza azida de hidrogênio para a detecção ativa e determinação de vários elementos e compostos. Forma ativamente complexos com metais específicos, permitindo sua quantificação por métodos colorimétricos ou de titulação.
- Pesquisa Bioquímica: Na pesquisa bioquímica, os cientistas usam ativamente azida de hidrogênio para modificar biomoléculas e estudar suas funções. Reage seletivamente com determinados grupos funcionais, contribuindo ativamente para a identificação e caracterização de moléculas biológicas.
- Fotografia: Na fotografia tradicional em preto e branco, a azida de hidrogênio funciona ativamente como um sensibilizador em emulsões, melhorando a sensibilidade à luz dos filmes fotográficos e levando ativamente a uma melhor qualidade de imagem.
- Inibidor de corrosão: As indústrias estão usando ativamente azida de hidrogênio como inibidor de corrosão para metais, especialmente cobre e suas ligas. Forma ativamente uma camada protetora na superfície do metal, prevenindo ativamente a corrosão e prolongando a vida útil de vários equipamentos e estruturas.
- Geradores de gás: A azida de hidrogênio desempenha ativamente um papel em geradores de gás para airbags e sistemas de resgate. Sua rápida decomposição libera ativamente gás nitrogênio, fornecendo a força necessária para a inflação e a implantação.
Questões:
P: O ácido hidrazóico é cáustico?
R: Sim, o ácido hidrazóico é considerado cáustico e pode causar queimaduras e danos aos tecidos por contato.
P: O ácido hidrazóico é um ácido forte?
R: Sim, o ácido hidrazóico é classificado como um ácido forte, capaz de ionizar-se completamente em água para liberar íons hidrônio.
P: O ácido hidrazóico é um ácido ternário?
R: Não, o ácido hidrazóico não é um ácido ternário. Os ácidos ternários contêm três elementos diferentes (hidrogênio, oxigênio e um terceiro elemento), enquanto o ácido hidrazóico contém apenas hidrogênio, nitrogênio e oxigênio.
P: Quantos ml de ácido hidrazóico por 12,5ml?
R: A pergunta parece incompleta e requer informações adicionais para uma resposta precisa.
P: Qual é a estrutura de Lewis correta para o ácido hidrazóico (HN3), incluindo cargas formais, se houver?
R: A estrutura de Lewis correta para HN3 consiste em um átomo de nitrogênio central ligado a três outros átomos de nitrogênio e um átomo de hidrogênio. Cargas formais podem ser determinadas com base nas diferenças de eletronegatividade.
P: Como o ácido hidrazóico afeta a citocromo c oxidase?
R: A azida de hidrogênio inibe a citocromo c oxidase, uma enzima envolvida na respiração celular, ligando-se ao seu sítio ativo e interrompendo sua função.
P: Qual é o Ka do ácido hidrazóico se o ácido hidrazóico 0,20 M tem um pH de 3,21?
R: O Ka do ácido hidrazóico pode ser calculado usando o pH e a equação Ka = [H3O+][A-]/[HA]. Mais informações são necessárias para determinar o valor de Ka.
P: Qual é o estado de oxidação do nitrogênio no ácido hidrazóico (HN3)?
R: O estado de oxidação do nitrogênio no ácido hidrazóico é -1.
P: Qual é o pH de uma solução 0,15 molar de HN3 se Ka = 1,8 × 10 ^ -9?
R: O pH de uma solução 0,15 molar de HN3 pode ser calculado usando o valor Ka e a equação pH = -log10(sqrt(Ka × [HA])).
P: Como equilibrar N2 + H2 em HN3?
R: A equação balanceada para a reação N2 + H2 → HN3 seria 3N2 + 6H2 → 2HN3.
P: Como calcular o Ka do HN3?
R: O Ka do HN3 pode ser calculado usando a concentração de equilíbrio dos produtos e reagentes na reação de dissociação do HN3.
P: Qual é a molaridade do NaN3 se a molaridade do HN3 é 0,012 M?
R: A molaridade do NaN3 não pode ser determinada sem informações adicionais ou a equação balanceada para a reação entre NaN3 e HN3.
P: Qual é a estrutura de Lewis correta para o ácido hidrazóico (HN3), incluindo cargas formais, se houver?
R: A estrutura de Lewis correta para HN3 inclui um átomo de nitrogênio central ligado a três outros átomos de nitrogênio e um átomo de hidrogênio. Cargas formais podem ser determinadas com base nas diferenças de eletronegatividade.
