Amida de sódio (NaNH2) é um composto químico. É composto por átomos de sódio e nitrogênio. É usado como base forte em diversas reações químicas.
| Nome IUPAC | Amida de sódio |
| Fórmula molecular | NaNH2 |
| Número CAS | 7782-92-5 |
| Sinônimos | Sodamida, azanida de sódio, amida de sódio, nitreto de sódio |
| InChI | InChI=1S/NaN2/c2-1-3/q-1 |
Propriedades da amida de sódio
Fórmula de amida de sódio
A fórmula da amida de sódio é NaNH2. Consiste em um átomo de sódio (Na), um átomo de hidrogênio (H) e um átomo de nitrogênio (N). Esta fórmula química representa a composição da amida de sódio em nível molecular.
Massa molar de Amida de Sódio
A massa molar do azaneto de sódio é calculada somando as massas atômicas de seus elementos constituintes. O sódio tem massa atômica de 22,99 gramas por mol (g/mol) e o nitrogênio tem massa atômica de 14,01 g/mol. Ao somar esses valores, vemos que a massa molar do azaneto de sódio é de aproximadamente 39 g/mol.
Ponto de ebulição da amida de sódio
O ponto de ebulição do azaneto de sódio é a temperatura na qual ele muda de líquido para gás. O azaneto de sódio tem um ponto de ebulição relativamente alto, cerca de 850 graus Celsius (°C). A esta temperatura, as forças intermoleculares que mantêm unidas as moléculas de azaneto de sódio são superadas, resultando na conversão do estado líquido para o estado gasoso.
Ponto de fusão da amida de sódio
O ponto de fusão do azaneto de sódio é a temperatura na qual ele muda de sólido para líquido. O azaneto de sódio tem um ponto de fusão relativamente baixo, em torno de 210 graus Celsius (°C). A esta temperatura, a estrutura cristalina do azaneto de sódio sólido se quebra, permitindo que as partículas se movam livremente, formando um líquido.
Densidade de amida de sódio g/mL
A densidade do azaneto de sódio é uma medida de sua massa por unidade de volume. A densidade da azanida de sódio é de aproximadamente 1,39 gramas por mililitro (g/mL). Este valor indica que a azanida de sódio é uma substância relativamente densa.
Peso molecular da amida de sódio
O peso molecular do azaneto de sódio é a soma dos pesos atômicos de todos os átomos de sua fórmula química. O peso molecular da azanida de sódio é de aproximadamente 39 gramas por mol (g/mol).
Estrutura da amida de sódio
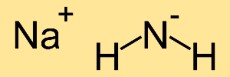
A estrutura do azaneto de sódio consiste em um átomo de sódio (Na) ligado a dois átomos de nitrogênio (N). Os átomos de nitrogênio formam um arranjo linear com o átomo de sódio no meio, resultando em uma estrutura molecular linear.
Solubilidade da amida de sódio
A azanida de sódio é pouco solúvel em água. Reage com a água para formar hidróxido de sódio (NaOH) e amônia (NH3). No entanto, é solúvel em alguns solventes orgânicos, como amônia líquida e álcoois líquidos. A solubilidade da azanida de sódio nesses solventes permite sua utilização em diversas reações químicas.
| Aparência | Sólido branco |
| Gravidade Específica | 1,39g/ml |
| Cor | Branco |
| Cheiro | Semelhante à amônia |
| Massa molar | 39 g/mol |
| Densidade | 1,39g/ml |
| Ponto de fusão | 210ºC |
| Ponto de ebulição | 850°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage |
| Solubilidade | Solúvel em solventes orgânicos, como amônia líquida e álcoois líquidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Alcalino (acima de 7) |
Segurança e perigos da amida de sódio
A azanida de sódio apresenta certos riscos e perigos à segurança que precisam ser considerados. Reage violentamente com a água, liberando gás tóxico amônia e hidróxido de sódio corrosivo. Portanto, deve ser manuseado com extremo cuidado para evitar o contato com umidade ou água. A azanida de sódio também é uma base forte, que pode causar queimaduras graves e lesões oculares se entrar em contato com a pele ou os olhos. A inalação de poeira ou vapores pode irritar o sistema respiratório. É aconselhável usar equipamentos de proteção adequados, como luvas, óculos de proteção e respirador, ao trabalhar com azanida de sódio. Ventilação adequada e armazenamento longe de substâncias incompatíveis são medidas de segurança essenciais.
| Símbolos de perigo | Corrosivo, Nocivo, Tóxico |
| Descrição de segurança | Manuseie com extremo cuidado. Evite contato com água/umidade. Use equipamento de proteção. São necessários ventilação e armazenamento adequados. |
| Números de identificação da ONU | ONU 1410 |
| Código SH | 28500020 |
| Classe de perigo | 4,3 (Perigoso quando molhado), 6,1 (Tóxico), 8 (Corrosivo) |
| Grupo de embalagem | II |
| Toxicidade | Tóxico por ingestão, inalação ou contato com a pele/olhos |
Métodos para a síntese de amida de sódio
Existem vários métodos para sintetizar azanida de sódio.
Um método comum é a reação entre sódio metálico e amônia gasosa (NH3) . Neste processo, o sódio metálico reage com o gás amônia sob condições controladas para produzir azaneto de sódio. A reação geralmente ocorre em um reator equipado com medidas de segurança apropriadas.
Outro método envolve a reação entre hidreto de sódio (NaH) e gás amônia . O hidreto de sódio, um composto sólido, reage com o gás amônia para produzir azaneto de sódio e gás hidrogênio. Atmosferas inertes são frequentemente utilizadas para realizar esta reação para evitar reações colaterais indesejadas.
Além disso, a reação entre o sódio metálico e a amônia líquida permite a preparação de azanida de sódio. Este método envolve a dissolução do sódio metálico em amônia líquida, resultando na formação de azaneto de sódio e gás hidrogênio.
Para sintetizar azanida de sódio, a azida de sódio (NaN3) reage com o hidróxido de sódio (NaOH). A reação entre esses dois compostos produz azaneto de sódio, bem como a liberação de gás nitrogênio.
Deve-se notar que estes métodos sintéticos requerem conhecimentos especializados e precauções de segurança adequadas devido à reatividade e aos perigos associados à azanida de sódio.
Usos da amida de sódio
O azaneto de sódio encontra aplicações em vários campos devido às suas propriedades únicas. Aqui estão alguns de seus usos:
- Base forte em reações de química orgânica: O azaneto de sódio desprotona ácidos fracos, facilitando a síntese de diversos compostos orgânicos.
- Fonte de nitrogênio nas reações: O azaneto de sódio introduz átomos de nitrogênio nas moléculas orgânicas, desempenhando um papel crucial na síntese de produtos farmacêuticos, corantes e polímeros.
- Desidrohalogenação: A azanida de sódio remove haletos de hidrogênio de compostos orgânicos em reações de desidrohalogenação. Este processo facilita a preparação de alcenos, alcinos e outros compostos insaturados.
- Reações de abertura de anel: A azanida de sódio participa de reações de abertura de anel de compostos cíclicos, como a síntese de Gabriel, convertendo aminas cíclicas em aminas primárias.
- Dessulfurização: O azaneto de sódio pode remover átomos de enxofre de compostos orgânicos, possibilitando reações de dessulfurização. Isto é útil na produção de combustíveis isentos de enxofre e na redução do impacto ambiental de compostos contendo enxofre.
- Armazenamento de hidrogênio: Os pesquisadores investigaram o uso potencial de azaneto de sódio em sistemas de armazenamento de hidrogênio. Ele pode reagir com o gás hidrogênio, formando hidreto de sódio, que pode então liberar hidrogênio após aquecimento.
- Suporte catalisador: A azanida de sódio pode atuar como suporte catalítico, melhorando o desempenho de certas reações catalíticas. Garante a estabilidade e melhora a eficiência dos catalisadores em diversas transformações químicas.
No geral, as propriedades versáteis do azaneto de sódio o tornam um composto valioso em síntese orgânica, química do nitrogênio e outras aplicações industriais.
Questões:
P: O que o NaNH2 faz?
R: NaNH2 é uma base forte comumente usada em reações de química orgânica para desprotonar ácidos fracos e facilitar várias transformações.
P: O que é NaNH2?
R: NaNH2 é amida de sódio, um composto químico que consiste em íons sódio (Na) e azanida (NH2), frequentemente usado como reagente e base forte em síntese orgânica.
P: Para que é usado o NaNH2 excessivo?
R: O excesso de NaNH2 pode levar à desprotonação adicional de átomos de hidrogênio ácidos em uma reação, aumentando assim a extensão da desprotonação e potencialmente alterando o resultado da reação.
P: O que o NaNH2 faz com um alceno?
R: O NaNH2 pode extrair um átomo de hidrogênio de um alceno, resultando na formação de um alcano e um composto de alcóxido de sódio.
P: O que o NaNH2 faz com o bromobenzeno?
R: O NaNH2 pode substituir o átomo de bromo no bromobenzeno por meio de uma reação de substituição nucleofílica, resultando na formação de fenilamina sódica.
P: O NaNH2 é uma base forte?
R: Sim, o NaNH2 é uma base forte capaz de aceitar prótons e desprotonar ácidos fracos devido à presença do íon amida.
P: Que reação ocorrerá se H2O for adicionado a uma mistura NaNH2/NH3?
R: Adicionar H2O a uma mistura NaNH2/NH3 resulta na geração de gás amônia (NH3) e hidróxido de sódio (NaOH) devido à reação entre a água e a base forte NaNH2.
P: Qual intermediário está envolvido nesta reação: NaNH2 + NH3 líquido?
R: O intermediário envolvido na reação do NaNH2 com o NH3 líquido é um elétron solvatado, formado pela doação de um elétron do sódio para a amônia.
P: O NaNH2 é um bom nucleófilo?
R: Sim, o NaNH2 pode atuar como um bom nucleófilo devido à sua capacidade de doar um par de elétrons e participar de reações de substituição nucleofílica.
P: O NaNH2 é iônico ou covalente?
R: NaNH2 é um composto iônico composto de íons de sódio carregados positivamente (Na+) e íons amida carregados negativamente (NH2-).
P: A 2-hexina reagirá com a amida de sódio?
R: Sim, a 2-hexina pode reagir com a amida de sódio, resultando na formação de acetileto de sódio e do composto alcino correspondente.
P: Qual é a base mais forte entre a amida de sódio e o fenoxato de sódio?
R: A azanida de sódio é a base mais forte que o fenoxato de sódio devido à maior basicidade do íon amida (NH2-) em comparação com o íon fenox (C6H5O-).
