Cloreto de sulfurila (SO2Cl2) é um composto formado pela combinação de dióxido de enxofre e cloro. É utilizado como reagente em reações químicas e como fumigante no controle de pragas.
| Nome IUPAC | Cloreto de sulfurila |
| Fórmula molecular | SO2Cl2 |
| Número CAS | 7791-25-5 |
| Sinônimos | Dicloreto sulfúrico, Oxicloreto de enxofre, Óxido de dicloreto de enxofre |
| InChI | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Propriedades do cloreto de sulfurila
Fórmula de Cloreto de Sulfurila
A fórmula química do dicloreto sulfúrico é SO2Cl2. É derivado da combinação de um átomo de enxofre, dois átomos de oxigênio e dois átomos de cloro. Esta fórmula representa a composição e arranjo dos átomos em uma molécula de dicloreto sulfúrico.
Massa molar de cloreto de sulfurila
A massa molar do dicloreto sulfúrico pode ser calculada somando as massas atômicas de seus elementos constituintes. O dicloreto sulfúrico tem massa molar de aproximadamente 134,97 gramas por mol. Este valor é importante para vários cálculos de reações químicas e estequiometria.
Ponto de ebulição do cloreto de sulfurila
O dicloreto sulfúrico tem um ponto de ebulição de aproximadamente 69 graus Celsius. Quando a temperatura sobe acima deste ponto, o dicloreto sulfúrico sofre uma mudança de fase, passando de líquido para gasoso. O ponto de ebulição é um parâmetro crucial na determinação das condições sob as quais o dicloreto sulfúrico pode ser usado ou manuseado.
Ponto de fusão do cloreto de sulfurila
O ponto de fusão do dicloreto sulfúrico é de aproximadamente -54 graus Celsius. Em temperaturas abaixo deste ponto, o dicloreto sulfúrico muda do estado sólido para o estado líquido. O ponto de fusão é importante para o armazenamento e manuseio do dicloreto sulfúrico porque indica as condições sob as quais ele solidifica ou liquefaz.
Densidade de cloreto de sulfurila g/mL
A densidade do dicloreto sulfúrico é de aproximadamente 1,638 gramas por mililitro (g/mL). A densidade representa a massa de uma substância por unidade de volume e ajuda a determinar seu comportamento físico. A densidade do dicloreto sulfúrico é importante para compreender sua flutuabilidade, solubilidade e compatibilidade com outras substâncias.
Peso molecular do cloreto de sulfurila
O peso molecular do dicloreto sulfúrico é de aproximadamente 134,97 unidades de massa atômica (u). É a soma das massas atômicas dos átomos constituintes de uma molécula de dicloreto sulfúrico. O peso molecular fornece informações cruciais para vários cálculos químicos e para determinar a quantidade de substância em uma determinada amostra.
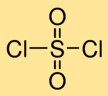
Estrutura do cloreto de sulfurila
O dicloreto sulfúrico tem uma estrutura molecular na qual um átomo de enxofre está ligado duplamente a dois átomos de oxigênio e ligado individualmente a dois átomos de cloro. Este arranjo forma um átomo central de enxofre rodeado por átomos de oxigênio e cloro, dando ao dicloreto sulfúrico sua estrutura característica.
Solubilidade do cloreto de sulfurila
O dicloreto sulfúrico é pouco solúvel em água. Reage com a água para produzir ácido clorídrico e ácido sulfúrico, tornando-o hidroliticamente reativo. No entanto, o dicloreto sulfúrico apresenta alguma solubilidade em solventes orgânicos, tais como hidrocarbonetos clorados e compostos aromáticos, tornando-os adequados para determinadas aplicações.
| Aparência | Líquido incolor |
| Gravidade Específica | 1.638g/mL |
| Cor | N / D |
| Cheiro | Pungente, sufocante |
| Massa molar | 134,97 g/mol |
| Densidade | 1.638g/mL |
| Ponto de fusão | -54ºC |
| Ponto de ebulição | 69ºC |
| Ponto flash | N / D |
| Solubilidade em Água | Reage vigorosamente |
| Solubilidade | Solúvel em solventes orgânicos, como hidrocarbonetos clorados e compostos aromáticos |
| Pressão de vapor | 43,6 mmHg (a 25°C) |
| Densidade do vapor | 4,43 (ar = 1) |
| pKa | N / D |
| pH | N / D |
Segurança e perigos do cloreto de sulfurila
O dicloreto sulfúrico apresenta vários riscos à segurança e devem ser tomadas precauções ao manuseá-lo. É uma substância corrosiva que pode causar queimaduras graves na pele, olhos e trato respiratório por contato. A inalação direta de seus vapores pode causar irritação respiratória e danos aos pulmões. Reage violentamente com a água, liberando gases tóxicos e apresentando risco de explosão. Portanto, é importante manusear o dicloreto sulfúrico em área bem ventilada e usar equipamentos de proteção adequados, como luvas, óculos de proteção e proteção respiratória. Os derramamentos devem ser limpos imediatamente usando procedimentos apropriados e armazenados em local fresco e seco, longe de materiais incompatíveis.
| Símbolos de perigo | Corrosivo (C), Oxidante (O) |
| Descrição de segurança | Causa queimaduras na pele e lesões oculares graves. Reage violentamente com água. |
| Números de identificação da ONU | ONU 1834 (dicloreto sulfúrico) |
| Código SH | 28121000 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II (Perigo médio) |
| Toxicidade | Muito tóxico; Nocivo se ingerido, inalado ou absorvido pela pele. |
Métodos para a síntese de cloreto de sulfurila
As pessoas geralmente usam alguns métodos para sintetizar dicloreto sulfúrico.
Um método envolve a reação entre dióxido de enxofre (SO2) e cloro gasoso (Cl2) . Na presença de um catalisador, como carvão ativado ou cloreto de alumínio, os gases reagem para formar dicloreto sulfúrico (SO2Cl2). Esta reação geralmente ocorre em altas temperaturas, em torno de 100 a 200°C.
Outro método de síntese de dicloreto sulfúrico envolve a reação do trióxido de enxofre (SO3) com cloreto de hidrogênio (HCl). Sob condições controladas, estes dois compostos combinam-se para produzir dicloreto sulfúrico. Esta reação é exotérmica e geralmente ocorre na fase gasosa.
O processo do cloreto de tionila gera dicloreto sulfúrico pela reação à temperatura ambiente do ácido sulfúrico (H2SO4) com pentacloreto de fósforo (PCl5) . Essa reação gera dicloreto sulfúrico e também subprodutos como ácido fosfórico (H3PO4) e cloreto de hidrogênio (HCl). Ambientes industriais geralmente usam esse método.
É importante notar que estes métodos de síntese requerem um manuseamento cuidadoso dos reagentes e a consideração de precauções de segurança devido à reactividade e natureza perigosa das substâncias envolvidas.
Além disso, os químicos costumam usar equipamentos apropriados, como condensadores e sistemas de refluxo, para controlar as condições de reação e garantir a síntese bem-sucedida de dicloreto sulfúrico.
Usos do cloreto de sulfurila
O dicloreto sulfúrico (SO2Cl2) encontra diversas aplicações em diferentes indústrias devido às suas propriedades únicas. Aqui estão alguns usos principais do dicloreto sulfúrico:
- Reagente Químico: A síntese orgânica normalmente utiliza o dicloreto sulfúrico como um reagente químico versátil, onde participa ativamente de diversas reações incluindo cloração, sulfonação e esterificação, permitindo a introdução de cloro, enxofre ou funcionalidades ácidas em compostos orgânicos.
- Pesticida e Fumigante: O dicloreto sulfúrico atua como um potente fumigante para controlar pragas em grãos armazenados, moinhos de farinha e instalações de processamento de alimentos, eliminando ativamente insetos, larvas e pragas que podem danificar produtos agrícolas armazenados devido às suas fortes propriedades biocidas.
- Polimerização: Na polimerização de monômeros específicos, como o cloreto de vinila, o dicloreto sulfúrico atua como catalisador ou iniciador ativo, facilitando a produção do cloreto de polivinila (PVC), um polímero termoplástico amplamente utilizado com aplicações nas indústrias de construção, automobilística e elétrica.
- Produtos farmacêuticos: O dicloreto sulfúrico desempenha ativamente um papel crucial na síntese de compostos farmacêuticos, especialmente sulfonamidas, que são antibióticos essenciais e agentes terapêuticos utilizados para tratar diversas infecções.
- Fabricação de corantes: O dicloreto sulfúrico participa ativamente da produção de corantes, principalmente aqueles que contêm enxofre ou cloro. Introduz ativamente grupos funcionais desejados e melhora a solidez da cor e a estabilidade do corante.
- Intermediários químicos: O dicloreto sulfúrico serve como intermediário ativo na síntese de outros produtos químicos, incluindo dióxido de enxofre, ácido sulfúrico e cloretos de sulfonila, que encontram aplicações em muitas indústrias, como produção de detergentes, fabricação de plásticos e produtos farmacêuticos.
- Tratamento de Água: Para purificação e desinfecção da água, o dicloreto sulfúrico neutraliza e elimina ativamente bactérias, vírus e outros microorganismos nocivos presentes nas fontes de água.
- Aplicações laboratoriais: Vários procedimentos laboratoriais utilizam ativamente dicloreto sulfúrico, por exemplo, para a detecção e determinação de aminas primárias e secundárias. Reage ativamente com aminas para formar sulfonamidas estáveis, facilitando sua análise e caracterização.
Questões:
P: Qual é o número total de gramas de moléculas de SO2Cl2 em 13,5 g de cloreto de sulfurila?
R: O número total de gramas de moléculas de SO2Cl2 em 13,5 g de cloreto de sulfurila pode ser calculado dividindo a massa dada pela massa molar de SO2Cl2.
P: O SO2Cl2 é polar ou apolar?
R: SO2Cl2 é uma molécula polar devido à presença de ligações polares e uma geometria molecular assimétrica.
P: Quando a pressão do SO2Cl2 diminuirá?
R: A queda de pressão do SO2Cl2 depende de vários fatores, como temperatura, volume e condições de reação. Isso não pode ser determinado apenas com base no tempo.
P: Qual é a pressão parcial de SO2Cl2 nesta mistura?
R: A pressão parcial de SO2Cl2 em uma mistura pode ser determinada usando a lei dos gases ideais, dependendo da temperatura, volume e fração molar ou concentração de SO2Cl2.
P: Que tipo(s) de forças intermoleculares são esperadas entre as moléculas de SO2Cl2?
R: As forças intermoleculares esperadas entre as moléculas de SO2Cl2 incluem interações dipolo-dipolo e forças de dispersão de London.
P: Em que ponto a pressão parcial de SO2Cl2 diminuirá para um décimo do seu valor inicial?
R: O tempo necessário para que a pressão parcial do SO2Cl2 diminua para um décimo do seu valor inicial depende das condições específicas do sistema e da taxa da reação química envolvida.
P: Qual é a massa molar do SO2Cl2?
R: A massa molar de SO2Cl2 é aproximadamente 134,97 gramas por mol.
P: Qual é a geometria molecular do SO2Cl2?
R: A geometria molecular do SO2Cl2 é curva ou em forma de V, com um átomo de enxofre no centro ligado a dois átomos de oxigênio e dois átomos de cloro.
P: Qual é a estrutura de Lewis do SO2Cl2?
R: A estrutura de Lewis do SO2Cl2 consiste em um átomo de enxofre duplamente ligado a um átomo de oxigênio e uma ligação simples a outro átomo de oxigênio, com dois átomos de cloro ligados ao átomo de enxofre.
