O óxido de fósforo (P2O5) é um composto químico. É formado a partir da combinação de dois átomos de fósforo e cinco átomos de oxigênio.
| Nome da IUPAC | Pentóxido de fósforo |
| Fórmula molecular | P2O5 |
| Número CAS | 1314-56-3 |
| Sinônimos | Anidrido fosfórico, óxido de fósforo (V), pentóxido de difósforo |
| InChI | InChI=1S/2O.P2/c2*1-3-2 |
Propriedades do óxido de fósforo
Fórmula de Óxido de Fósforo
A fórmula do pentóxido de difósforo é P2O5. É composto por dois átomos de fósforo e cinco átomos de oxigênio. Esta fórmula química representa a proporção de elementos no composto.
Massa molar de óxido de fósforo
A massa molar do pentóxido de difósforo (P2O5) é calculada somando as massas atômicas de seus elementos constituintes. O fósforo tem massa atômica de aproximadamente 31,0 gramas por mol, enquanto o oxigênio tem massa atômica de aproximadamente 16,0 gramas por mol. A massa molar de P2O5 é, portanto, aproximadamente 141,9 gramas por mol.
Ponto de ebulição do óxido de fósforo
O pentóxido de difósforo não possui um ponto de ebulição específico. Em vez disso, sofre uma reação química quando aquecido, transformando-se em ácido fosfórico (H3PO4) e liberando calor no processo. Portanto, não possui ponto de ebulição bem definido como muitos outros compostos.
Ponto de fusão do óxido de fósforo
O pentóxido de difósforo (P2O5) tem um ponto de fusão de aproximadamente 340 graus Celsius (644 graus Fahrenheit). A esta temperatura, o composto sólido passa para o estado líquido. É importante notar que o pentóxido de difósforo é altamente higroscópico, o que significa que absorve prontamente a umidade do ar.
Densidade de óxido de fósforo g/mL
A densidade do pentóxido de difósforo é de aproximadamente 2,39 gramas por mililitro (g/mL). A densidade é uma medida de massa por unidade de volume e este valor indica o quão pesada ou compacta é a substância. A densidade do pentóxido de difósforo contribui para suas propriedades físicas e comportamento em diversas aplicações.
Peso molecular do óxido de fósforo
O peso molecular do pentóxido de difósforo (P2O5) é de aproximadamente 141,9 gramas por mol. Este valor representa a soma das massas atômicas de fósforo e oxigênio no composto. O peso molecular é frequentemente usado em cálculos que envolvem reações químicas e estequiometria de compostos.
Estrutura do óxido de fósforo
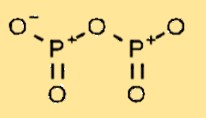
O pentóxido de difósforo tem uma estrutura molecular que consiste em dois átomos de fósforo ligados a cinco átomos de oxigênio. O arranjo dos átomos forma uma estrutura cíclica, com cada átomo de fósforo ligado a dois átomos de oxigênio e compartilhando uma ligação dupla com o átomo de fósforo vizinho.
Solubilidade do óxido de fósforo
O pentóxido de difósforo não é solúvel em água. Reage vigorosamente com a água para formar ácido fosfórico, liberando calor. No entanto, é solúvel em alguns solventes orgânicos, como dissulfeto de carbono e clorofórmio. As características de solubilidade do pentóxido de difósforo desempenham um papel na sua reatividade química e aplicações.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,39g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 141,9 g/mol |
| Densidade | 2,39g/ml |
| Ponto de fusão | 340°C (644°F) |
| Ponto de ebulição | Reage para formar ácido fosfórico |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage com água para formar ácido fosfórico |
| Solubilidade | Solúvel em solventes orgânicos, como dissulfeto de carbono, clorofórmio |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do óxido de fósforo
O pentóxido de difósforo (P2O5) apresenta alguns riscos de segurança e deve-se ter cuidado ao manuseá-lo. Reage violentamente com a água, liberando calor e formando ácido fosfórico, que pode causar queimaduras e irritações na pele, olhos e aparelho respiratório. É importante evitar o contato com a substância e utilizar equipamentos de proteção adequados, como luvas, óculos de proteção e respirador, ao trabalhar com pentóxido de difósforo. Além disso, é fundamental armazenar o composto em recipiente bem fechado, longe de umidade e materiais incompatíveis. Deve ser fornecida ventilação adequada para evitar o acúmulo de vapores.
| Símbolos de perigo | Corrosivo, prejudicial |
| Descrição de segurança | – Provoca queimaduras graves na pele e lesões oculares – Pode ser prejudicial se ingerido ou inalado – Reage violentamente em contacto com a água – Manter afastado da humidade e de materiais incompatíveis |
| Números de identificação da ONU | Um 1807 |
| Código SH | 2819.10.90 |
| Classe de perigo | Classe 8 (substâncias corrosivas) |
| Grupo de embalagem | PG II (Perigo Médio) |
| Toxicidade | Tóxico para a vida aquática, podendo causar efeitos nefastos a longo prazo no ambiente aquático |
Métodos de síntese de óxido de fósforo
Vários métodos podem ser usados para sintetizar pentóxido de difósforo (P2O5).
Um método comum envolve a queima de fósforo na presença de excesso de oxigênio. Esta reação produz pentóxido de fósforo na forma de um resíduo sólido branco. A equação para este processo é P4 + 5O2 → 2P2O5.
Outro método envolve a oxidação controlada de compostos de fósforo, como tricloreto de fósforo (PCl3) ou tribrometo de fósforo (PBr3) , utilizando oxigênio ou ar. A reação geralmente ocorre em altas temperaturas e o produto resultante é o pentóxido de fósforo.
Para obter pentóxido de difósforo, o ácido fosfórico (H3PO4) pode ser desidratado aquecendo-o em alta temperatura. Este processo remove moléculas de água e resulta na formação de pentóxido de fósforo.
Outro método de preparação de pentóxido de difósforo envolve a decomposição térmica de certos sais de fosfato. Por exemplo, o aquecimento de dihidrogenofosfato de amônio (NH4H2PO4) ou fosfato de amônio ((NH4)3PO4) leva à formação de pentóxido de fósforo.
Ao sintetizar o pentóxido de difósforo, é fundamental ter cautela devido à sua reatividade e geração de calor durante reações específicas. Devem ser seguidas precauções de segurança adequadas, como trabalhar em uma área bem ventilada e usar equipamento de proteção adequado.
Esses métodos sintéticos fornecem caminhos para a aquisição de pentóxido de difósforo, que encontra aplicações em vários campos, incluindo a produção de ácido fosfórico, fertilizantes e intermediários químicos.
Usos do óxido de fósforo
O pentóxido de difósforo (P2O5) encontra diversas aplicações em diversas indústrias devido às suas propriedades únicas. Aqui estão alguns usos comuns do pentóxido de difósforo:
- Produção de ácido fosfórico: A fabricação de ácido fosfórico utiliza amplamente o pentóxido de difósforo como precursor principal. O ácido fosfórico tem muitas aplicações em fertilizantes, aditivos alimentares e agentes de limpeza.
- Fabricação de fertilizantes: O pentóxido de difósforo desempenha um papel essencial na produção de vários fertilizantes fosfatados, incluindo fertilizantes superfosfato e fosfato de amônio. Esses fertilizantes fornecem às plantas nutrientes essenciais para promover um crescimento saudável.
- Intermediários Químicos: A síntese de vários compostos orgânicos, como produtos farmacêuticos, pesticidas e retardadores de chama, refere-se ao pentóxido de difósforo como intermediário químico.
- Dessecante: O pentóxido de difósforo tem forte afinidade com a água e atua como dessecante. É utilizado em diversas reações químicas para remover água e avançar nas reações desejadas.
- Catalisador: O pentóxido de difósforo atua como catalisador em reações químicas específicas. Facilita essas reações reduzindo a energia de ativação e aumentando assim as taxas de reação.
- Dessecante: A natureza higroscópica do pentóxido de difósforo o torna adequado para uso como dessecante em aplicações sensíveis à umidade. Ele absorve e remove efetivamente a umidade do ambiente.
- Fabricação de vidro: As formulações de vidro incorporam pentóxido de difósforo para modificar suas propriedades, incluindo expansão térmica e índice de refração. Vidros especiais, como vidros ópticos e vidros de borosilicato, utilizam-no ativamente.
- Tratamento de superfície metálica: Tratamentos de superfície metálica, como fosfatação, usam pentóxido de difósforo para melhorar a resistência à corrosão e melhorar a adesão da tinta às superfícies metálicas.
Estas diversas aplicações destacam a importância do pentóxido de difósforo em indústrias que vão desde a agricultura até a farmacêutica, tornando-o um composto valioso e amplamente útil.
Questões:
P: Qual é o número de oxidação do fósforo no íon PO?
R: O número de oxidação do fósforo no íon PO é +5.
P: Qual é o estado de oxidação de um átomo de fósforo individual em PO43−?
R: O estado de oxidação de um átomo de fósforo individual em PO43− é +5.
P: Qual é o número de oxidação do fósforo?
R: O número de oxidação do fósforo pode variar, mas geralmente aparece como +3 ou +5.
P: Qual é o nome do composto P2O5?
R: O nome do composto P2O5 é pentóxido de fósforo (V).
P: O que é P2O5?
R: P2O5 é um composto químico chamado pentóxido de fósforo (V).
P: Qual é o nome correto para P2O5?
R: O nome correto para P2O5 é pentóxido de fósforo (V).
P: Qual é o nome do P2O5?
R: O nome do P2O5 é pentóxido de fósforo (V).
P: O P2O5 é anfotérico?
R: Não, o P2O5 não é anfotérico. É um óxido ácido.
P: O que é fertilizante P2O5?
R: Fertilizante P2O5 refere-se a fertilizantes que contêm pentóxido de fósforo (V) (P2O5) como fonte de fósforo, que é importante para o crescimento das plantas.
P: O P2O5 é ácido ou básico?
R: P2O5 é um composto ácido.
P: O P2O5 é um composto iônico?
R: Não, P2O5 é um composto covalente.
P: Como calcular o P2O5 em fertilizantes?
R: Para calcular a quantidade de P2O5 em um fertilizante, multiplique a porcentagem de P2O5 pelo peso do fertilizante.
P: Propriedades do P2O5, solúvel?
R: O P2O5 é pouco solúvel em água, mas reage facilmente com a água para formar ácido fosfórico.
P: Quantos quilogramas de P em 14% P2O5?
R: Para calcular a quantidade de fósforo (P) em 14% P2O5, multiplique o peso do fertilizante por 0,14.
