O tribrometo de fósforo (PBr3) é um composto que consiste em um átomo de fósforo e três átomos de bromo. É utilizado como reagente em diversas reações químicas, principalmente na síntese de compostos orgânicos.
| Nome IUPAC | Tribrometo de fósforo |
| Fórmula molecular | PBr3 |
| Número CAS | 7789-60-8 |
| Sinônimos | Brometo de fósforo (III), brometo de bromofósforo, tribromofosfina |
| InChI | InChI=1S/Br3P/c1-4(2)3 |
Propriedades do tribrometo de fósforo
Fórmula de tribrometo de fósforo
A fórmula do brometo de fósforo (III) é PBr3. Consiste em um átomo de fósforo e três átomos de bromo. Este composto é formado quando o fósforo reage com o bromo. A fórmula representa com precisão a composição do composto.
Massa molar de tribrometo de fósforo
A massa molar do brometo de fósforo (III) pode ser calculada somando as massas atômicas de seus elementos constituintes. O fósforo tem massa atômica de aproximadamente 31,0 gramas por mol, enquanto o bromo tem massa atômica de aproximadamente 79,9 gramas por mol. Adicionar três vezes a massa atômica do bromo à massa atômica do fósforo nos dá a massa molar do brometo de fósforo (III), que é aproximadamente 270,7 gramas por mol.
Ponto de ebulição do tribrometo de fósforo
O brometo de fósforo (III) tem um ponto de ebulição de aproximadamente 173 graus Celsius. Isso significa que em temperaturas acima deste ponto, o composto sofrerá uma mudança de fase de líquido para gás. O ponto de ebulição é uma característica importante que ajuda a determinar as condições sob as quais o composto pode ser utilizado ou purificado.
Ponto de fusão do tribrometo de fósforo
O ponto de fusão do brometo de fósforo (III) é de aproximadamente -41 graus Celsius. Esta temperatura indica o ponto em que o composto muda do estado sólido para o estado líquido. Conhecer o ponto de fusão é crucial para manusear e manipular o composto em diversos processos químicos.
Densidade de tribrometo de fósforo g/mL
A densidade do brometo de fósforo (III) é de aproximadamente 2,85 gramas por mililitro (g/mL). A densidade mede a massa de uma substância por unidade de volume. Com a sua densidade relativamente alta, o brometo de fósforo (III) é mais denso do que muitos outros líquidos comuns, indicando que é relativamente pesado para o seu volume.
Peso molecular do tribrometo de fósforo
O peso molecular do brometo de fósforo (III) é de aproximadamente 270,7 gramas por mol. Este valor é calculado somando as massas atômicas de todos os átomos do composto, com base na fórmula molecular PBr3. O peso molecular é útil em vários cálculos, inclusive na determinação da quantidade de substância presente em uma determinada massa.
Estrutura do tribrometo de fósforo
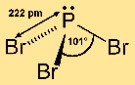
O brometo de fósforo (III) tem uma estrutura molecular piramidal. Consiste em um átomo central de fósforo ligado a três átomos de bromo. Este arranjo dá à molécula uma forma de pirâmide trigonal, com o átomo de fósforo no topo e os átomos de bromo na base. Essa estrutura é importante para a compreensão da reatividade e do comportamento do composto nas reações químicas.
Solubilidade do tribrometo de fósforo
O brometo de fósforo (III) é pouco solúvel em água. Ele reage com a água para produzir ácido bromídrico e ácido fosforoso. No entanto, é solúvel em solventes orgânicos como benzeno e tetracloreto de carbono. A solubilidade determina até que ponto um composto pode dissolver-se num solvente específico, o que tem implicações para as suas aplicações e manuseamento em vários processos.
| Aparência | Líquido incolor |
| Gravidade Específica | 2,85g/ml |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 270,7 g/mol |
| Densidade | 2,85g/ml |
| Ponto de fusão | -41ºC |
| Ponto de ebulição | 173°C |
| Ponto flash | Não disponível |
| Solubilidade em Água | Reage |
| Solubilidade | Solúvel em solventes orgânicos como benzeno e tetracloreto de carbono |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não disponível |
Segurança e perigos do tribrometo de fósforo
O brometo de fósforo (III) apresenta alguns riscos de segurança e deve ser manuseado com cautela. É corrosivo e pode causar queimaduras graves em contato com a pele, olhos ou sistema respiratório. A inalação ou ingestão direta deste composto pode causar irritação respiratória e gastrointestinal. Reage violentamente com a água, liberando vapores tóxicos e gerando calor. Ventilação adequada e equipamentos de proteção individual, como luvas e óculos de proteção, devem ser usados ao trabalhar com brometo de fósforo (III). Além disso, deve ser armazenado longe de substâncias incompatíveis para evitar possíveis reações. No geral, a adesão estrita aos protocolos de segurança e o conhecimento dos perigos associados a este composto são essenciais para um manuseamento seguro.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Manuseie com depósito. Evite o contato com a pele, olhos e sistema respiratório. Use ventilação adequada e equipamento de proteção individual. Armazene longe de substâncias incompatíveis. |
| Números de identificação da ONU | ONU1805 |
| Código SH | 2812.90.90 |
| Classe de perigo | 8 (Corrosivo) |
| Grupo de embalagem | II |
| Toxicidade | Tóxico por inalação e ingestão. Pode causar queimaduras graves e irritação. |
Métodos para a síntese de tribrometo de fósforo
Num método comum de síntese de brometo de fósforo (III), o recipiente de reação combina diretamente fósforo elementar e bromo, geralmente sob condições controladas. A reação prossegue com a transferência de átomos de bromo para átomos de fósforo, resultando na formação de brometo de fósforo (III).
Outro método envolve a reação entre tricloreto de fósforo (PCl3) e brometo de hidrogênio (HBr) . Nesta abordagem, o tricloreto de fósforo reage primeiro com o gás brometo de hidrogênio, produzindo brometo de fósforo (III) e gás cloreto de hidrogênio como subprodutos. Este método oferece uma rota alternativa para a obtenção de brometo de fósforo (III).
No “método do fósforo vermelho”, o fósforo vermelho é combinado com bromo ou ácido bromídrico e a reação é realizada sob condições controladas. O fósforo vermelho serve como fonte de fósforo, reagindo com o bromo ou ácido bromídrico para produzir brometo de fósforo (III).
Esses métodos sintéticos abrem caminhos para a produção de brometo de fósforo (III), cada um com suas próprias vantagens e considerações. A escolha do método depende de fatores como disponibilidade de reagentes, rendimento desejado e condições específicas de reação. É importante realizar essas sínteses em um laboratório bem equipado, respeitando os protocolos e procedimentos de segurança para o manuseio dos produtos químicos envolvidos.
Usos do tribrometo de fósforo
O brometo de fósforo (III) encontra diversas aplicações devido à sua reatividade e propriedades únicas. Aqui estão alguns de seus usos:
- Síntese orgânica: Os químicos utilizam amplamente o brometo de fósforo (III) como reagente na síntese orgânica para converter álcoois em brometos de alquila, uma etapa fundamental na síntese de muitos compostos orgânicos.
- Indústria Farmacêutica: A produção de produtos farmacêuticos depende fortemente do brometo de fósforo (III) para sintetizar vários intermediários de medicamentos e ingredientes farmacêuticos ativos (API).
- Retardadores de chama: Os fabricantes utilizam brometo de fósforo(III) na produção de retardadores de chama, melhorando as propriedades de resistência ao fogo de certos polímeros para uso em indústrias como eletrônica e têxtil.
- Fabricação de produtos químicos: O brometo de fósforo (III) serve como um valioso intermediário na produção de outros produtos químicos, incluindo compostos de fósforo, como derivados de ácido fosfórico, fosfonatos e fosfatos.
- Herbicidas e Pesticidas: A síntese de ingredientes ativos específicos utilizados em herbicidas e pesticidas utiliza brometo de fósforo (III) para controlar eficazmente ervas daninhas, pragas e doenças na agricultura.
- Pesquisa de Laboratório: No laboratório, os pesquisadores costumam usar o brometo de fósforo (III) como reagente em diversos experimentos e reações, especialmente aqueles que envolvem bromação e manipulação de compostos orgânicos.
- Análise química: O brometo de fósforo (III) encontra aplicação em técnicas de análise química, permitindo a determinação da presença de grupos funcionais específicos em compostos orgânicos através de reações de substituição de bromo.
Esses diversos usos destacam a importância do brometo de fósforo (III) em síntese orgânica, produtos farmacêuticos, retardadores de chama, fabricação de produtos químicos, agricultura, pesquisa laboratorial e análises químicas. Sua reatividade e versatilidade fazem dele um composto valioso em diversas indústrias e disciplinas científicas.
Questões:
P: Por que o AlBr3 é chamado de brometo de alumínio enquanto o PBr3 é tribrometo de fósforo?
R: A convenção de nomenclatura para compostos envolvendo metais geralmente usa o nome elementar do metal seguido do nome do não metal, enquanto no caso do PBr3, o fósforo é especificado para indicar a presença de um átomo central de fósforo.
P: Qual palavra ou frase de duas palavras descreve melhor a forma do tribrometo de fósforo?
R: A forma do brometo de fósforo (III) é melhor descrita como trigonal piramidal.
P: Quantos elétrons de valência existem na molécula de tribrometo de fósforo, PBr3?
R: O brometo de fósforo (III) (PBr3) tem 26 elétrons de valência.
P: O tribrometo de fósforo é iônico ou covalente?
R: O brometo de fósforo (III) (PBr3) é um composto covalente.
P: Qual é a fórmula química do tribrometo de fósforo?
R: A fórmula química do brometo de fósforo (III) é PBr3.
P: Estrutura de Lewis para tribrometo de fósforo, PBr3?
R: A estrutura de Lewis do PBr3 mostra o fósforo como o átomo central rodeado por três átomos de bromo ligados, cada um conectado por uma ligação simples.
P: O PBr3 é uma inversão?
R: Não, o brometo de fósforo (III) (PBr3) não apresenta inversão.
P: O PBr3 é um eletrófilo?
R: Sim, o PBr3 pode atuar como eletrófilo em certas reações, onde aceita elétrons.
P: Qual é a geometria molecular do PBr3?
R: A geometria molecular do PBr3 é trigonal piramidal.
P: O PBr3 é polar ou apolar?
R: PBr3 é uma molécula polar devido à distribuição desigual da densidade eletrônica causada pela presença de ligações polares P-Br.
P: Quantos moles de PBr3 contêm 3,68 × 10 ^ 25 átomos de bromo?
R: Para determinar o número de moles, precisamos da massa molar do PBr3, depois dividimos o número dado de átomos de bromo pelo número de Avogadro.
P: Qual é o nome correto para PBr3?
R: O nome correto para PBr3 é brometo de fósforo (III).
P: O PBr3 é polar?
R: Sim, o PBr3 é uma molécula polar devido à presença de ligações polares e à distribuição desigual da densidade eletrônica.
