O dicloreto de enxofre (SCl₂) é um composto químico formado pela combinação de enxofre e cloro. É usado em diversas indústrias para fazer corantes, borracha e pesticidas.
| Nome IUPAC | Dicloreto de enxofre |
| Fórmula molecular | SCl₂ |
| Número CAS | 10545-99-0 |
| Sinônimos | Monossulfeto de cloro, cloreto sulfuroso, dicloreto de enxofre, cloreto de enxofre, diclorossulfano |
| InChI | InChI=1S/Cl2S/c1-3-2 |
Propriedades do dicloreto de enxofre
Fórmula de dicloreto de enxofre
A fórmula do cloreto de enxofre é SCl₂. Representa a combinação de um átomo de enxofre e dois átomos de cloro. Esta fórmula química reflete com precisão a composição e estrutura do composto.
Massa molar de dicloreto de enxofre
A massa molar do cloreto de enxofre pode ser calculada somando as massas atômicas de seus elementos constituintes. O enxofre tem massa molar de 32,06 g/mol e o cloro tem massa molar de 35,45 g/mol. Ao adicionar as massas de dois átomos de cloro e um átomo de enxofre, a massa molar do cloreto de enxofre é determinada como sendo aproximadamente 102,91 g/mol.
Ponto de ebulição do dicloreto de enxofre
O cloreto de enxofre tem um ponto de ebulição de 138,8°C (281,8°F). Esta temperatura indica o ponto em que o composto líquido muda para o estado gasoso sob pressão atmosférica padrão. É importante considerar o ponto de ebulição do cloreto de enxofre ao manuseá-lo ou utilizá-lo em diversas aplicações.
Ponto de fusão de dicloreto de enxofre
O ponto de fusão do cloreto de enxofre é -76,8°C (-106,2°F). Esta temperatura representa o ponto em que o composto sólido passa para o estado líquido. Conhecer o ponto de fusão é essencial ao trabalhar com cloreto de enxofre para garantir manuseio e armazenamento adequados.
Densidade de dicloreto de enxofre g/mL
O cloreto de enxofre tem uma densidade de aproximadamente 1,64 g/mL. O valor da densidade indica a quantidade de massa por unidade de volume da substância. Esta propriedade é essencial para a compreensão do comportamento e das características do cloreto de enxofre em diferentes contextos, como durante reações químicas ou para determinar sua adequação para aplicações específicas.
Peso molecular do dicloreto de enxofre
O peso molecular do cloreto de enxofre é de aproximadamente 102,91 g/mol. Representa a massa total de uma molécula do composto, calculada pela soma das massas atômicas de seus elementos constituintes. O peso molecular fornece informações valiosas sobre a massa do composto e permite medições precisas em vários cálculos químicos.
Estrutura do dicloreto de enxofre
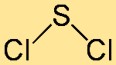
A estrutura do cloreto de enxofre é melhor descrita como uma molécula curva ou em forma de V. Consiste em um átomo central de enxofre ligado a dois átomos de cloro. O arranjo dos átomos e seus ângulos de ligação contribuem para a estabilidade geral e a reatividade do composto.
Solubilidade do dicloreto de enxofre
O cloreto de enxofre tem solubilidade limitada em água. É pouco solúvel e tende a formar uma solução turva quando misturado com água. As características de solubilidade do composto são importantes a serem consideradas ao determinar sua compatibilidade com outras substâncias e seu comportamento em diferentes solventes.
| Aparência | Líquido amarelo |
| Gravidade Específica | 1,64g/ml |
| Cor | AMARELO |
| Cheiro | Acre |
| Massa molar | 102,91 g/mol |
| Densidade | 1,64g/ml |
| Ponto de fusão | -76,8ºC |
| Ponto de ebulição | 138,8ºC |
| Ponto flash | Não disponível |
| Solubilidade em Água | Reage |
| Solubilidade | Solúvel em ácido acético glacial, benzeno, bromo |
| Pressão de vapor | 35,4mmHg |
| Densidade do vapor | 3,9 (ar=1) |
| pKa | Não disponível |
| pH | Não disponível |
Segurança e perigos do dicloreto de enxofre
O cloreto de enxofre apresenta vários riscos de segurança e deve ser manuseado com cautela. É muito corrosivo e pode causar queimaduras graves em contato com a pele, olhos ou mucosas. A inalação dos seus vapores pode irritar o sistema respiratório e causar tosse, dificuldade em respirar e danos nos pulmões. Também é inflamável e pode inflamar-se na presença de certas substâncias. Ao trabalhar com cloreto de enxofre, devem ser utilizados equipamentos de proteção adequados, como luvas, óculos de proteção e proteção respiratória. É imprescindível manusear e armazenar este composto em área bem ventilada, longe de fontes de ignição e materiais incompatíveis, para evitar acidentes e potenciais danos.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Evite contato, use equipamento de proteção, trabalhe em áreas bem ventiladas |
| Números de identificação da ONU | Um 1828 |
| Código SH | 2812.10.00 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos para a síntese de dicloreto de enxofre
Existem vários métodos para sintetizar cloreto de enxofre. Uma abordagem comum envolve a reação entre enxofre e cloro gasoso. Neste processo, o excesso de cloro está presente quando o enxofre é aquecido a uma temperatura específica, geralmente em torno de 200-250°C (392-482°F). A reação prossegue para formar cloreto de enxofre.
Outro método envolve a reação entre cloreto de tionila (SOCl₂) e enxofre. O cloreto de tionila atua como fonte de cloro, que reage com o enxofre para produzir cloreto de enxofre. Esta reação ocorre a uma temperatura relativamente mais baixa do que o método direto de enxofre-cloro.
A reação entre cloreto de sulfurila (SO₂Cl₂) e sulfeto de hidrogênio (H₂S) permite a preparação de cloreto de enxofre. Esta reação ocorre em altas temperaturas e produz cloreto de enxofre e outros subprodutos.
Para garantir a segurança do pessoal envolvido, é fundamental realizar a síntese do cloreto de enxofre em laboratórios ou ambientes industriais bem equipados. O pessoal deve seguir as precauções de segurança adequadas, incluindo o uso de equipamento de proteção e o trabalho em áreas bem ventiladas, devido à natureza perigosa do composto.
A escolha do método de síntese depende de vários fatores, incluindo disponibilidade de matérias-primas, pureza desejada do produto e requisitos específicos de aplicação. A seleção da técnica apropriada depende das necessidades específicas do processo ou aplicação, pois cada método tem suas próprias vantagens e considerações.
Usos do dicloreto de enxofre
O cloreto de enxofre (SCl₂) encontra aplicações em diversas indústrias e processos devido às suas propriedades específicas. Aqui estão alguns usos principais do cloreto de enxofre:
- Fabricação de corantes: Os fabricantes usam cloreto de enxofre para produzir corantes, principalmente corantes de enxofre, que conferem cores vibrantes aos tecidos da indústria têxtil.
- Indústria da Borracha: A indústria da borracha utiliza SCl₂ como agente vulcanizante para melhorar a resistência e a elasticidade dos produtos de borracha por meio da reticulação de cadeias de polímeros.
- Síntese de pesticidas: O cloreto de enxofre desempenha um papel crucial na síntese de certos pesticidas, possibilitando a produção de inseticidas e fungicidas chamados compostos organofosforados e organotiofosfatos.
- Síntese química: SCl₂ serve como um reagente versátil em diversas reações químicas, possibilitando reações de cloração, como a conversão de álcoois em cloretos de alquila ou a síntese de compostos orgânicos clorados.
- Reagente de laboratório: Os laboratórios usam cloreto de enxofre como reagente para múltiplas aplicações, incluindo síntese orgânica, química de enxofre e reações inorgânicas.
- Tratamento de Água: Os processos de tratamento de água usam SCl₂ como desinfetante e agente oxidante para remover microorganismos nocivos e poluentes orgânicos das fontes de água.
- Indústria farmacêutica: O cloreto de enxofre encontra aplicações na pesquisa e desenvolvimento farmacêutico, particularmente na síntese de certos ingredientes farmacêuticos ativos (API).
- Análise química: Técnicas de química analítica, como cromatografia gasosa, usam SCl₂ para detectar e analisar compostos específicos.
Estas diversas aplicações destacam a importância do cloreto de enxofre em vários processos industriais e empreendimentos científicos. No entanto, é importante manusear e utilizar o cloreto de enxofre com cuidado, seguindo as orientações e procedimentos de segurança adequados devido à sua natureza perigosa.
Questões:
P: Qual é a fórmula do dicloreto de enxofre?
R: A fórmula do cloreto de enxofre é SCl₂.
P: Qual fórmula representa o composto molecular dicloreto de enxofre?
R: O composto molecular cloreto de enxofre é representado pela fórmula SCl₂.
P: O dicloreto de enxofre é polar?
R: Sim, o cloreto de enxofre é polar devido à presença de geometria molecular curva e distribuição desigual de densidade eletrônica.
P: Quais orbitais atômicos ou híbridos constituem a ligação sigma entre S e Cl no dicloreto de enxofre, SCl₂?
R: A ligação sigma entre o enxofre (S) e o cloro (Cl) no cloreto de enxofre (SCl₂) é formada pela sobreposição do orbital 3p do enxofre e do orbital 3p do cloro.
P: O SCl₂ é linear?
R: Não, o cloreto de enxofre (SCl₂) não é linear. Possui uma geometria molecular curva ou em forma de V.
P: Qual dos seguintes é um composto iônico? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
R: Nenhum dos compostos listados são compostos iônicos. Estes são compostos moleculares (Cl₂O, CH₂O, SCl₂, PF₅) ou um composto de fosfato inorgânico (Mg₃(PO₄)₂).
P: Qual é o nome do composto com a fórmula SCl₂?
R: O composto com a fórmula SCl₂ é chamado cloreto de enxofre.
P: Qual é a forma de SCl₂?
R: SCl₂ tem uma forma molecular curva ou em forma de V.
P: Qual é a geometria molecular do SCl₂?
R: A geometria molecular do SCl₂ é curva ou em forma de V.
P: Quais são os nomes dos orbitais híbridos usados pelo enxofre no SCl₂?
R: O átomo de enxofre em SCl₂ usa orbitais híbridos sp².
P: O que acontece quando um átomo de enxofre se combina com dois átomos de cloro para produzir SCl₂?
R: Quando um átomo de enxofre se combina com dois átomos de cloro, forma o composto SCl₂, conhecido como cloreto de enxofre. O átomo de enxofre compartilha elétrons com os átomos de cloro para criar uma ligação covalente entre eles.
