O cloreto de tionila é um composto químico utilizado em diversas aplicações industriais. Reage com álcoois e ácidos carboxílicos, produzindo os correspondentes cloretos e cloreto de sulfurila, respectivamente.
| Nome da IUPAC | Cloreto de Tionilo |
| Fórmula molecular | SOCl₂ |
| Número CAS | 7719-09-7 |
| Sinônimos | Dicloreto de enxofre, Oxicloreto de enxofre, Dicloreto de tionila |
| InChI | InChI=1S/Cl2OS/c1-4(2)3 |
Propriedades do cloreto de tionila
Fórmula de cloreto de tionila
A fórmula do dicloreto de tionila é SOCl₂, representando um átomo de enxofre ligado a dois átomos de cloro. É um composto químico amplamente utilizado em diversas indústrias.
Massa molar de cloreto de tionila
O dicloreto de tionila tem uma massa molar de aproximadamente 118,97 gramas por mol. A massa molar é determinada pela soma das massas atômicas de seus elementos constituintes.
Ponto de ebulição do cloreto de tionila
O dicloreto de tionila tem um ponto de ebulição de aproximadamente 79,6 graus Celsius. Esta é a temperatura na qual a forma líquida do dicloreto de tionila muda para o estado gasoso.
Ponto de fusão do cloreto de tionila
O ponto de fusão do dicloreto de tionila é de aproximadamente -104,5 graus Celsius. Esta é a temperatura na qual a forma sólida do dicloreto de tionila muda para o estado líquido.
Densidade de cloreto de tionila g/mL
O dicloreto de tionila tem uma densidade de aproximadamente 1,64 gramas por mililitro. Densidade é a medida de massa por unidade de volume e é uma característica importante de uma substância.
Peso molecular do cloreto de tionila
O peso molecular do dicloreto de tionila é de aproximadamente 118,97 gramas por mol. É calculado somando os pesos atômicos de enxofre, cloro e oxigênio.
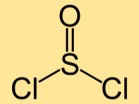
Estrutura do cloreto de tionila
A estrutura do dicloreto de tionila consiste em um átomo de enxofre ligado a dois átomos de cloro. Os átomos de enxofre e cloro estão dispostos linearmente, formando uma molécula curva.
Solubilidade do cloreto de tionila
O dicloreto de tionila é pouco solúvel em água, mas se dissolve facilmente em solventes orgânicos como benzeno, tolueno e tetracloreto de carbono. Sua solubilidade é um fator importante em suas aplicações.
| Aparência | Líquido incolor a amarelo pálido |
| Gravidade Específica | 1.638g/mL |
| Cor | Incolor |
| Cheiro | Pungente, sufocante |
| Massa molar | 118,97 g/mol |
| Densidade | 1.638g/mL |
| Ponto de fusão | -104,5ºC |
| Ponto de ebulição | 79,6ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage violentamente |
| Solubilidade | Solúvel em solventes orgânicos como benzeno, tolueno e tetracloreto de carbono |
| Pressão de vapor | 4,33kPa a 20°C |
| Densidade do vapor | 3,9 (ar = 1) |
| pKa | -6,3 |
| pH | Não aplicável |
Segurança e perigos do cloreto de tionila
O dicloreto de tionila apresenta vários riscos à segurança e deve ser manuseado com cuidado. É muito corrosivo e pode causar queimaduras graves em contato com a pele, olhos ou mucosas. A inalação de seus vapores pode causar irritação e danos respiratórios. O composto reage violentamente com a água, liberando gases tóxicos, como o cloreto de hidrogênio. Portanto, deve ser armazenado e manuseado longe de fontes de umidade. O dicloreto de tionila também reage vigorosamente com álcoois e compostos que contêm água, o que pode resultar em risco de incêndio ou explosão. Ventilação adequada, equipamento de proteção individual e práticas de armazenamento adequadas são essenciais para garantir o manuseio seguro do dicloreto de tionila.
| Símbolos de perigo | Corrosivo (C), Tóxico (T), Perigoso para o Meio Ambiente (N) |
| Descrição de segurança | – Manter afastado de fontes de umidade e substâncias incompatíveis.<br>- Utilizar em área bem ventilada e usar equipamento de proteção individual adequado.<br>- Manusear com cuidado para evitar contato com a pele, olhos e mucosas.<br> – Armazenar em recipiente bem fechado, em local fresco e seco. |
| Números de identificação da ONU | Nº ONU 1836 (dicloreto de tionila) |
| Código SH | 2812.10.00 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II (moderadamente perigoso) |
| Toxicidade | Muito tóxico por inalação, ingestão e absorção pela pele.<br>- Pode causar queimaduras graves e irritação respiratória.<br>- Pode causar efeitos nocivos a longo prazo nos organismos aquáticos. |
Métodos para a síntese de cloreto de tionila
Diferentes métodos permitem a síntese de dicloreto de tionila.
Uma abordagem comum envolve a reação entre trióxido de enxofre (SO₃) e dicloreto de enxofre (SCl₂) na presença de um catalisador como carvão ativado ou cloreto de alumínio . A reação ocorre em altas temperaturas, geralmente em torno de 300 a 400 °C, e assim produz dicloreto de tionila.
Outro método envolve a reação direta de dióxido de enxofre (SO₂) com pentacloreto de fósforo (PCl₅) ou oxicloreto de fósforo (POCl₃). Essa reação ocorre em refluxo, com adição progressiva dos reagentes, e leva ao dicloreto de tionila.
A reação do enxofre com tricloreto de fósforo (PCl₃) dá dicloreto de tionila. Este processo envolve aquecer os reagentes e permitir a formação de dicloreto de tionila.
Outro método envolve a reação entre pentassulfeto de fósforo (P2S5) e pentacloreto de fósforo (PCl5) na presença de um catalisador ácido de Lewis, tal como cloreto de alumínio. A reação ocorre em altas temperaturas e resulta na formação de dicloreto de tionila.
É importante notar que estes métodos de síntese requerem manuseio adequado e precauções de segurança devido à natureza perigosa dos reagentes envolvidos. A síntese segura e eficiente do dicloreto de tionila requer a experiência de químicos experientes e o uso de equipamento de laboratório apropriado.
Usos do cloreto de tionila
O dicloreto de tionila encontra amplas aplicações em diversas indústrias devido às suas versáteis propriedades químicas. Aqui estão alguns usos comuns do dicloreto de tionila:
- Conversão de ácidos carboxílicos: O dicloreto de tionila converte ácidos carboxílicos em cloretos de acila, usando principalmente a reação de Vilsmeier-Haack em síntese orgânica.
- Cloração de álcool: O dicloreto de tionila reage com álcoois, formando cloretos de alquila e tendo aplicação na produção de compostos clorados para produtos farmacêuticos e agroquímicos, conhecida como reação de Darzens.
- Agente desidratante: O dicloreto de tionila atua como agente desidratante, facilitando a remoção de diversos compostos da água. É comumente utilizado na síntese de corantes, perfumes e intermediários farmacêuticos.
- Fabricação de baterias de íon-lítio: Os fabricantes usam dicloreto de tionila para produzir baterias de dicloreto de tionila-lítio, que possuem alta densidade de energia e longa vida útil. Essas baterias têm aplicações em dispositivos médicos, equipamentos militares e sensores remotos.
- Reações de polimerização: O dicloreto de tionila participa das reações de polimerização, contribuindo para a síntese de diversos polímeros, incluindo policarbonatos e polianidridos.
- Compostos de fósforo: O dicloreto de tionila reage com compostos de fósforo, como o tricloreto de fósforo, produzindo cloretos de fosforil. Os químicos usam esses intermediários para sintetizar compostos organofosforados e retardadores de chama.
- Reagente Químico: O dicloreto de tionila serve como um reagente versátil em muitas transformações químicas, incluindo esterificação, halogenação e reações de substituição nucleofílica.
Questões:
P: Com o que você pode enxaguar o cloreto de tionila?
R: O dicloreto de tionila pode ser enxaguado com grande excesso de álcool ou base compatível, como metanol ou solução de bicarbonato de sódio.
P: Qual é o produto do ácido valérico com cloreto de tionila?
R: A reação do ácido valérico com dicloreto de tionila produz cloreto de valeril, bem como gás dióxido de enxofre.
P: Você pode adicionar cloreto de tionila com ácido carboxílico?
R: Sim, o dicloreto de tionila pode ser adicionado a um ácido carboxílico para convertê-lo em cloreto de acila pela reação de Vilsmeier-Haack.
P: Qual das alternativas a seguir é a fórmula de Lewis correta para cloreto de tionila (SOCl2)?
R: A fórmula de Lewis correta para dicloreto de tionila (SOCl2) é representada por S=O | Cl – Cl.
P: O que impulsiona a reação do cloreto de tionila?
R: A reação do dicloreto de tionila é impulsionada pela alta reatividade do cloreto de tionila, que atua como eletrófilo em diversas transformações químicas.
P: Como extinguir o cloreto de tionila?
R: O dicloreto de tionila pode ser extinto adicionando um agente de extinção adequado, como um álcool primário ou secundário, ou hidrolisando-o cuidadosamente com água.
P: O que você obteria se misturasse aminas com cloreto de tionila?
A: A mistura de aminas com dicloreto de tionila resulta na formação dos correspondentes sais de cloridrato de amina.
P: O que é cloreto de tionila?
R: O dicloreto de tionila é um composto químico com a fórmula SOCl2, comumente usado como reagente em síntese orgânica e como agente desidratante.
P: O que o excesso de cloreto de tionila fará?
R: O excesso de dicloreto de tionila pode causar reações vigorosas, possivelmente resultando na produção de gases tóxicos ou riscos de explosão, e deve ser manuseado com cautela.
P: Como neutralizar o cloreto de tionila?
R: O dicloreto de tionila pode ser neutralizado adicionando-o cuidadosamente a um grande excesso de uma base adequada, como bicarbonato de sódio ou hidróxido de sódio, garantindo ao mesmo tempo as precauções de segurança adequadas.
