4-Etilfenol ou C8H10O é um composto químico de odor doce, picante e herbáceo, utilizado em perfumes, aromatizantes e como fungicida na agricultura. Também pode ser um subproduto da deterioração do vinho.
| Nome IUPAC | 4-etilfenol |
| Fórmula molecular | C8H10O |
| Número CAS | 104-96-7 |
| Sinônimos | p-etilfenol, 4-hidroxietilbenzeno, 4-EHP |
| InChI | InChI=1S/C8H10O/c1-7-3-2-6-4-8(7)5-9/h2-5,9H.6H2.1H3 |
Fórmula 4-etilfenol
A fórmula do 4-etilfenol é C8H10O. A fórmula fornece o número e os tipos de átomos na molécula e é usada para calcular sua massa molar, peso molecular e outras propriedades.
RMN C8H10O
A espectroscopia de ressonância magnética nuclear (NMR) permite aos cientistas estudar a estrutura e composição das moléculas. Ao analisar o espectro de RMN C8H10O do 4-etilfenol, eles podem identificar mudanças químicas, constantes de acoplamento e intensidades de pico que revelam informações sobre a estrutura e composição da molécula.
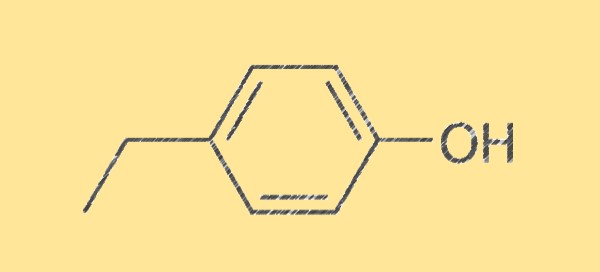
Estrutura do 4-etilfenol C8H10O
A estrutura do 4-etilfenol é caracterizada pela sua fórmula molecular, C8H10O, composta por oito átomos de carbono, dez átomos de hidrogênio e um átomo de oxigênio. É um líquido incolor com odor doce, picante e herbáceo. A molécula é simétrica e possui um grupo hidroxila (-OH) ligado a um átomo de carbono, tornando-a um fenol.
Massa molar de 4-etilfenol
A massa molar do 4-etilfenol é 134,17 g/mol. Massa molar é definida como a massa de uma substância contendo um mol de entidades, como átomos, moléculas ou íons. É calculado somando as massas atômicas de todos os elementos da molécula. No caso do 4-etilfenol, sua fórmula molecular (C8H10O) nos dá a massa molar de 134,17 g/mol.
Ponto de ebulição do 4-etilfenol
O ponto de ebulição do 4-etilfenol é 218,7°C. O ponto de ebulição de uma substância é a temperatura na qual sua pressão de vapor se iguala à pressão atmosférica e o líquido se transforma em vapor. O ponto de ebulição do 4-etilfenol é relativamente alto devido às forças de atração intermoleculares presentes na molécula.
Ponto de fusão do 4-etilfenol
O ponto de fusão do 4-etilfenol é 9,7°C. O ponto de fusão de uma substância é a temperatura na qual ela passa de sólido para líquido. O ponto de fusão do 4-etilfenol é relativamente baixo devido ao seu baixo peso molecular e à falta de fortes forças intermoleculares.
Densidade de 4-etilfenol g/ml
A densidade do 4-etilfenol é 1,02 g/mL. A densidade de uma substância é definida como sua massa por unidade de volume. É calculado dividindo a massa de uma amostra de substância pelo seu volume. A densidade do 4-etilfenol é relativamente baixa devido ao seu baixo peso molecular e à falta de fortes forças intermoleculares.
Peso molecular de 4-etilfenol
O peso molecular do 4-etilfenol é 134,17 g/mol. O peso molecular é igual à massa molar e é calculado somando as massas atômicas de todos os elementos da molécula. No caso do 4-etilfenol, sua fórmula molecular (C8H10O) nos dá o peso molecular de 134,17 g/mol.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,02 g/ml |
| Cor | Incolor |
| Cheiro | Cheiro doce, picante e herbáceo |
| Massa molar | 134,17 g/mol |
| Densidade | 1,02 g/ml |
| Ponto de fusão | 9,7°C |
| Ponto de ebulição | 218,7°C |
| Ponto flash | 100ºC |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | 32 mmHg (20°C) |
| Densidade do vapor | 2,4 (ar = 1) |
| pKa | 9,5 |
| pH | Neutro |
Segurança e perigos do 4-etilfenol
Armazene o 4-etilfenol longe de fontes de calor e ignição, pois é um líquido inflamável. O contato direto pode causar irritação na pele e nos olhos, e a inalação de seus vapores ou névoas pode causar irritação respiratória. Proteja-se usando luvas de proteção, óculos de segurança e respirador ao manusear 4-etilfenol. Manuseie-o com cuidado e descarte-o adequadamente de acordo com as regulamentações locais.
| Símbolos de perigo | Líquido inflamável, irritante |
| Descrição de segurança | S2: Manter fora do alcance das crianças; S24/25: Evitar contato com pele e olhos; S36/37/39: Use roupas de proteção, luvas e proteção para os olhos/face adequados. |
| Números de identificação da ONU | ONU 1993, Líquido inflamável, NOS (4-etilfenol) |
| Código SH | 2909.30.90 |
| Classe de perigo | 3 |
| Grupo de embalagem | III |
| Toxicidade | LD50 oral (rato) = 5.400 mg/kg. Pode causar irritação na pele e nos olhos. A inalação de seus vapores ou névoa pode causar irritação respiratória. |
Métodos para a síntese de 4-etilfenol
O 4-etilfenol é sintetizado pela reação do fenol com óxido de etileno na presença de um catalisador alcalino, como hidróxido de sódio ou hidróxido de potássio. A reacção ocorre a uma temperatura de 60-80°C e à pressão atmosférica. A proporção molar de fenol para óxido de etileno varia de 1:1 a 1:2, dependendo do rendimento desejado e da pureza do 4-etilfenol. A mistura de reação é então neutralizada e destilada para obter o produto desejado.
Um método de síntese alternativo envolve a reação de 4-cloro-o-cresol com óxido de etileno na presença de um catalisador alcalino, tal como hidróxido de sódio ou hidróxido de potássio. A reacção ocorre a uma temperatura de 60-80°C e à pressão atmosférica. A proporção molar de 4-cloro-o-cresol para óxido de etileno varia de 1:1 a 1:2, dependendo do rendimento desejado e da pureza do 4-etilfenol. A mistura de reação é então neutralizada e destilada para obter o produto desejado.
É importante notar que ambos os métodos requerem um controle cuidadoso da temperatura, pressão e concentração do catalisador para atingir o rendimento e a pureza desejados do 4-etilfenol. A mistura de reação também deve ser cuidadosamente monitorada quanto à presença de impurezas, como subprodutos de reação ou contaminantes das matérias-primas, para garantir a qualidade do produto final.
Usos do 4-etilfenol
As indústrias utilizam amplamente o 4-etilfenol como ingrediente de fragrância em produtos de higiene pessoal e domésticos, como perfumes, sabonetes, detergentes e velas, devido ao seu odor doce, picante e herbáceo. A indústria alimentícia utiliza 4-etilfenol como agente aromatizante em doces, assados e bebidas alcoólicas. Como precursor, também produz outros compostos, como o p-cresol, para as indústrias farmacêutica e de química fina.
Os fabricantes utilizam o 4-etilfenol na produção de resinas, plastificantes e outros polímeros, bem como na síntese de borracha e fragrâncias sintéticas. Os pesquisadores também estão estudando seu potencial como agente antifúngico devido aos seus efeitos inibitórios sobre o crescimento fúngico.
Órgãos reguladores como a União Europeia, a Administração de Alimentos e Medicamentos dos Estados Unidos e a Associação Internacional de Fragrâncias regulam o uso de 4-etilfenol para garantir seu uso seguro e responsável. O uso seguro do 4-etilfenol requer uma consideração cuidadosa de seus potenciais efeitos à saúde e ao meio ambiente, bem como manuseio e armazenamento adequados.
Questões:
O que são etilfenóis?
Os etilfenóis são um grupo de compostos orgânicos que contêm o grupo funcional fenol e um grupo etil (-C2H5) ligado ao anel fenol. São classificados como álcoois aromáticos e possuem diferentes propriedades físicas e químicas dependendo da localização do grupo etil no anel fenol. Exemplos comuns de etilfenóis incluem 4-etilfenol e 2-etilfenol. Esses compostos têm diversos usos nas indústrias de perfumes, alimentos e química, bem como na síntese de outros produtos químicos. No entanto, o uso de etilfenóis é regulamentado devido a preocupações sobre os seus potenciais efeitos para a saúde e o ambiente, e a sua utilização segura requer uma consideração cuidadosa dos seus requisitos de manuseamento e armazenamento.
Qual é a estrutura do composto descrito pelos dados espectrais abaixo? fórmula c8h10o
Os dados espectrais por si só não podem determinar definitivamente a estrutura de um composto, mas podem fornecer informações para identificá-lo. A fórmula C8H10O sugere que o composto é um álcool aromático, o que pode ser confirmado pela presença de um grupo funcional álcool, indicado por um pico OH no espectro IR.
O espectro de RMN de 1H poderia fornecer informações sobre o número e tipo de átomos de hidrogênio na molécula, como a presença de hidrogênios aromáticos e hidrogênios alifáticos, bem como quaisquer grupos funcionais. O espectro de RMN de 13C também poderia fornecer informações sobre o tipo de átomos de carbono presentes na molécula e seu ambiente.
Com base nessas informações é possível deduzir a estrutura do composto, mas seriam necessárias informações e análises adicionais para confirmá-la definitivamente. Algumas estruturas possíveis para um composto com a fórmula C8H10O poderiam incluir fenol, cresóis ou xilenois, entre outros.
Qual você acha que é a estrutura do espectro de RMN representada pela fórmula química c8h10o?
Você pode determinar a estrutura provável de uma molécula com a fórmula química C8H10O como um álcool aromático. Você esperaria ver um sinal singleto ou dupleto para o próton hidroxila e vários picos para o sinal do próton aromático no espectro de RMN de 1H. No espectro de RMN de 13C, você vê sinais para os carbonos do anel aromático e do grupo carbonila.
Vários fatores, como ambiente, solvente e concentração da molécula, bem como impurezas ou isômeros, podem impactar os espectros de RMN. Para determinar definitivamente a estrutura da molécula, é necessário analisar e interpretar o espectro de RMN real, embora seja possível fazer uma previsão com base na fórmula química.
Como calcular os graus de insaturação de c8h10o?
Os graus de insaturação de uma molécula podem ser calculados usando a fórmula:
Graus de insaturação = (2 + número de anéis) + (número de ligações duplas / 2)
A molécula de fórmula C8H10O possui apenas um anel porque é um anel aromático. A molécula não possui ligações duplas porque é um álcool e não contém ligações duplas.
Portanto, os graus de insaturação para C8H10O seriam calculados da seguinte forma:
Graus de insaturação = (2 + 1) + (0/2) = 3
Este resultado indica que a molécula C8H10O possui três graus de insaturação e, portanto, é provável que seja um álcool aromático. O cálculo dos graus de insaturação fornece uma maneira rápida e conveniente de estimar a estrutura molecular de um composto e identificar se ele contém grupos funcionais ou anéis insaturados. Deve notar-se, no entanto, que este método tem algumas limitações e não é adequado para todos os compostos.
O que é c8h10o?
C8H10O é a fórmula química de uma molécula contendo 8 átomos de carbono, 10 átomos de hidrogênio e 1 átomo de oxigênio. A molécula pode ser um dos muitos compostos químicos diferentes, incluindo álcoois aromáticos como fenol, cresóis ou xilenois, entre outros.
Técnicas como espectroscopia infravermelha, espectroscopia de ressonância magnética nuclear ou espectrometria de massa determinam a verdadeira identidade da molécula com base na sua estrutura e propriedades moleculares.
