O 2-buteno (CH3CHCHCH3) é um gás incolor utilizado na produção de diversos produtos químicos. É inflamável e exala um leve odor. O 2-buteno é comumente usado na fabricação de borracha sintética e outros polímeros.
| Nome da IUPAC | Mais-2-ène |
| Fórmula molecular | C4H8 ou CH3CHCHCH3 |
| Número CAS | 624-64-6 |
| Sinônimos | 2-Buteno, Butileno, Etiletileno, But-2-eno, B-Buteno, Buteno-2 |
| InChI | InChI=1S/C4H8/c1-3-4-2/h3-4H,1-2H3 |
Propriedades do 2-buteno
Fórmula 2-Buteno
A fórmula química do 2-buteno é C4H8. Isso significa que a molécula contém quatro átomos de carbono e oito átomos de hidrogênio. A fórmula fornece informações sobre os tipos e números de átomos presentes na molécula, mas não fornece informações sobre sua estrutura ou propriedades.
Massa molar de 2-buteno
But-2-eno tem massa molar de 56,11 g/mol. Massa molar é a massa de um mol de uma substância e é calculada somando as massas atômicas de todos os átomos da molécula. Para o but-2-eno, existem quatro átomos de carbono e oito átomos de hidrogênio, dando um total de 56,11 g/mol.
Ponto de ebulição do 2-buteno
O ponto de ebulição do but-2-eno é 0,88°C. O ponto de ebulição é a temperatura na qual um líquido se transforma em gás. No caso do but-2-eno, é um gás incolor à temperatura ambiente, mas pode ser condensado em líquido diminuindo a temperatura. A 0,88°C, o but-2-eno começará a ferver e se transformará em gás.
Ponto de fusão de 2-buteno
O but-2-eno não tem um ponto de fusão distinto porque existe como gás à temperatura ambiente. No entanto, se for resfriado a uma temperatura suficientemente baixa, pode condensar-se em líquido. Neste ponto, a temperatura na qual solidifica dependerá das condições do experimento.
Densidade de 2-buteno g/mL
A densidade do but-2-eno é 0,614 g/mL à temperatura e pressão ambientes. Densidade é a quantidade de massa por unidade de volume. No caso do but-2-eno, isso significa que para cada mililitro de but-2-eno há 0,614 gramas de massa.
Peso Molecular de 2-Buteno
O peso molecular do but-2-eno é 56,11 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. No caso do but-2-eno, existem quatro átomos de carbono e oito átomos de hidrogênio, dando um total de 56,11 g/mol.
Estrutura 2-buteno
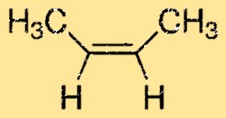
O but-2-eno tem uma estrutura linear e pertence ao grupo dos alcenos. Possui duas ligações duplas carbono-carbono, o que lhe confere sua reatividade característica. A molécula tem um átomo de carbono central com dois grupos metil ligados e dois átomos de hidrogênio ligados a cada um dos carbonos nas extremidades da molécula.
| Aparência | Gás incolor |
| Densidade específica | 0,614 a 25°C |
| Cor | Incolor |
| Cheiro | Benigno |
| Massa molar | 56,11 g/mol |
| Densidade | 0,614 g/mL a 25°C |
| Ponto de fusão | -139,8ºC |
| Ponto de ebulição | 0,88ºC |
| Ponto flash | -19ºC |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | 276,8kPa a 25°C |
| Densidade do vapor | 2,5 (ar = 1) |
| pKa | 44 |
| pH | Não aplicável |
Segurança e perigos do 2-buteno
O but-2-eno pode representar vários riscos à segurança se não for manuseado adequadamente. É altamente inflamável e pode inflamar-se facilmente quando exposto ao calor, chamas ou faíscas. Também é irritante respiratório e ocular e pode causar tonturas, dores de cabeça e náuseas quando inalado. Além disso, é prejudicial se ingerido e pode danificar órgãos internos. Medidas de segurança adequadas, como uso de equipamento de proteção e boa ventilação, devem ser seguidas ao manusear o but-2-eno. É importante ter formação adequada e conhecimento dos seus perigos potenciais antes de manusear o produto químico.
| Símbolos de perigo | Inflamável |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Use equipamento elétrico/de ventilação/iluminação à prova de explosão. Use apenas ferramentas que não produzam faíscas. Tome medidas preventivas contra descarga estática. Mantenha o recipiente bem fechado. Armazene em uma área bem ventilada. |
| Números de identificação da ONU | ONU1012 |
| Código SH | 290110 |
| Classe de perigo | 3 |
| Grupo de embalagem | II |
| Toxicidade | Nocivo se ingerido, irritante para o trato respiratório e os olhos. |
Métodos para a síntese de 2-buteno
Vários métodos podem sintetizar but-2-eno, incluindo craqueamento de hidrocarbonetos, desidratação de 2-butanol e desidrogenação catalítica de butanos.
O método de craqueamento envolve o aquecimento de hidrocarbonetos como a nafta, o diesel ou o querosene a altas temperaturas, fazendo com que se quebrem em moléculas menores, incluindo o but-2-eno. O processo pode ser realizado por craqueamento térmico ou catalítico.
Para produzir but-2-eno, as pessoas usam a desidratação do 2-butanol como outro método. Neste método, aquecem o 2-butanol com um agente desidratante, como ácido sulfúrico ou ácido fosfórico , para criar but-2-eno e água. A reação é reversível e eles podem remover a água da mistura reacional para impulsionar a reação em direção à formação de but-2-eno.
Outro método usado para sintetizar but-2-eno é a desidrogenação catalítica de butanos. Este processo envolve o aquecimento do butano sobre um catalisador como cromo-alumina ou platina para produzir but-2-eno e hidrogênio. A reação tem alta exotermicidade e os químicos podem realizá-la em um reator de leito fixo ou de leito fluidizado.
Usos de 2-buteno
O but-2-eno possui uma ampla gama de aplicações industriais e comerciais devido às suas propriedades químicas únicas. Aqui estão alguns usos comuns do but-2-eno:
- Produção de butadieno: É um precursor do butadieno, um produto químico utilizado na produção de borracha sintética e outros elastômeros.
- Fabricação de Plásticos: Utilizado na produção de plásticos de polietileno de alta densidade (PEAD) e polietileno linear de baixa densidade (PEBDL).
- Aditivo de combustível: usado como aditivo de combustível para aumentar a octanagem da gasolina.
- Solvente: Utilizado como solvente em diversas indústrias, como tintas, revestimentos e adesivos.
- Intermediário químico: utilizado como intermediário na produção de diversos produtos químicos, como butanol, butiraldeído e ácido butírico.
- Refrigerante: Usado como refrigerante em algumas aplicações devido ao seu baixo ponto de ebulição e boas propriedades de transferência de calor.
- Pesquisa e desenvolvimento: Também utilizado em pesquisa e desenvolvimento para estudar a cinética de reações e a termodinâmica de diversas reações químicas.
Questões:
P: O que melhor descreve a estrutura do 2-buteno?
R: But-2-eno é um hidrocarboneto insaturado com uma cadeia de quatro carbonos e uma ligação dupla entre o segundo e o terceiro átomo de carbono.
P: Qual é a hibridização nos dois átomos de carbono centrais do 2-buteno?
R: Os dois átomos de carbono centrais do but-2-eno são hibridizados sp², o que significa que cada um deles tem três orbitais hibridizados e um orbital p não hibridizado.
P: Quais reagentes podem ser usados para converter cis-2-buteno em trans-2-buteno?
R: Reagentes como bromo ou gás hidrogênio podem ser usados para converter cis-but-2-eno em trans-but-2-eno por meio de um processo chamado isomerização cis-trans.
P: Por que pode ser difícil visualizar a separação de cis- e trans-2-buteno por TLC?
R: Pode ser difícil visualizar a separação de cis- e trans-but-2-eno por cromatografia em camada delgada (TLC) porque os dois isômeros têm propriedades físicas muito semelhantes, como polaridade e ponto de origem. fervendo, dificultando sua diferenciação por TLC.
P: Quantos estereoisômeros únicos resultam da reação envolvendo trans-but-2-eno?
R: A reação envolvendo trans-but-2-eno dá origem a dois estereoisômeros únicos, porque existem apenas duas configurações possíveis de substituintes em torno da ligação dupla: trans e cis.
