2 A butanona, também conhecida como metiletilcetona ou MEK, é um líquido incolor e inflamável com um odor doce e frutado. É comumente usado como solvente em diversas aplicações industriais e domésticas.
| Nome IUPAC | 2-Butanona |
| Fórmula molecular | C4H8O |
| Número CAS | 78-93-3 |
| Sinônimos | Metiletilcetona (MEK), butan-2-ona, 2-butanona, 3-oxobutan-2-ona |
| InChI | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
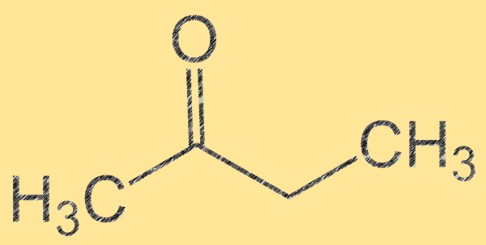
Estrutura da butanona
A butanona possui fórmula molecular C4H8O e sua estrutura molecular pode ser representada como CH3C(O)CH2CH3. É um líquido incolor e inflamável, com odor doce e frutado. Butanona é uma cetona, o que significa que contém um grupo carbonila (C=O) ligado a um átomo de carbono. Este grupo carbonila torna a butanona um intermediário importante na síntese de vários compostos orgânicos.
Massa molar de 2-butanona
A butanona, também conhecida como metiletilcetona (MEK), tem massa molar de 72,11 g/mol. Esta é a quantidade de substância numa determinada amostra de butanona, expressa em gramas por mol. A massa molar é uma propriedade importante da butanona que é usada em vários cálculos e experimentos em química, por exemplo, para determinar a massa de uma substância necessária para reagir com outra substância em uma proporção molar específica. A massa molar da butanona também pode ser usada para converter sua massa em moles, o que é útil em muitas aplicações, incluindo reações químicas, síntese química e química analítica.
Ponto de ebulição do MEK
O ponto de ebulição do MEK é 80,6°C (176,5°F). Esta é a temperatura na qual o MEK muda de líquido para gasoso. O ponto de ebulição é uma propriedade importante do MEK porque afeta sua capacidade de evaporar e formar vapor. Por exemplo, em algumas aplicações a MEK é utilizada como solvente e é desejável que evapore rapidamente para que o soluto possa ser removido. Em outras aplicações, é desejável que o MEK permaneça na sua forma líquida, de modo que possa ser utilizado como solvente para reações realizadas no seu ponto de ebulição ou abaixo dele.
Ponto de fusão MEK
O ponto de fusão do MEK é -93,9°C (-136,0°F). Esta é a temperatura na qual o MEK muda do estado sólido para o estado líquido. O ponto de fusão é uma propriedade importante do MEK porque afeta sua capacidade de ser usado como solvente para substâncias sólidas. Por exemplo, MEK pode ser usado como solvente para certos sólidos cujo ponto de fusão é inferior ao seu próprio ponto de fusão, como gorduras, ceras e resinas.
Densidade MEK g/mL
A densidade do MEK é 0,80 g/mL. Esta é a massa por unidade de volume de MEK e é uma propriedade importante usada em muitas aplicações, incluindo o cálculo da quantidade de MEK necessária para um volume específico. A densidade do MEK também é usada para calcular seu volume molar, que é o volume ocupado por um mol de MEK. Esta informação é útil em vários experimentos, incluindo a determinação da massa molar de uma substância.
Peso molecular de MEK
O peso molecular do MEK é 72,11 g/mol. É a soma dos pesos atômicos dos átomos de uma molécula de MEK e é uma propriedade importante usada em muitas aplicações, incluindo o cálculo da massa molar de uma substância. O peso molecular da MEK pode ser usado para converter sua massa em moles, o que é útil em muitas aplicações, incluindo reações químicas, síntese química e química analítica.
Fórmula MEK
A fórmula química do MEK é C4H8O. Esta fórmula representa proporções relativas.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,79 – 0,80 |
| Cor | Incolor |
| Cheiro | Doce, frutado |
| Massa molar | 72,11 g/mol |
| Densidade | 0,79 – 0,80g/mL |
| Ponto de fusão | -93,9°C (-136,0°F) |
| Ponto de ebulição | 80,6°C (176,5°F) |
| Ponto flash | 12°C (53,6°F) |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel na maioria dos solventes orgânicos |
| Pressão de vapor | 38mmHg (20°C) |
| Densidade do vapor | 2,3 (ar = 1) |
| pKa | 20.2 |
| pH | 7 (neutro) |
Nota: Os valores fornecidos nesta tabela são aproximados e podem variar ligeiramente dependendo da fonte e das condições de medição.
Segurança e perigos da butanona
A butanona, também conhecida como metiletilcetona, é um líquido inflamável e volátil que pode causar irritação na pele, olhos e trato respiratório se não for manuseado com as devidas precauções de segurança. A inalação de altas concentrações de butanona pode causar dor de cabeça, tontura, náusea e perda de consciência. A exposição prolongada a baixas concentrações de butanona pode causar danos renais e hepáticos. Também é altamente inflamável e pode inflamar-se facilmente, representando risco de incêndio. Ao usar butanona, é importante trabalhar em área bem ventilada, usar roupas e óculos de proteção e evitar contato com a pele. Em caso de contato com a pele ou olhos, lavar imediatamente com água e consultar um médico se necessário. Se ingerido, não provoque vômito e procure atendimento médico imediatamente. A butanona deve ser armazenada em local fresco, seco e bem ventilado, longe de fontes de calor e chamas.
| Símbolos de perigo | Líquido inflamável, Irritante |
| Descrição de segurança | S2 – Manter fora do alcance das crianças<br>S16 – Manter longe de fontes de ignição<br>S24/25 – Evitar contato com a pele e os olhos<br>S26 – Em caso de contato com os olhos, lavar imediatamente com água em abundância e procure orientação médica |
| Identificadores AN | UN1090 |
| Código SH | 29141100 |
| Classe de perigo | 3 (líquido inflamável) |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato) – 4.220 mg/kg |
Métodos de síntese de butanona
A butanona pode ser sintetizada por vários métodos, incluindo a oxidação direta do 2-butanol e a condensação aldólica da acetona e do 2-propanol.
O método de oxidação direta envolve a reação do 2-butanol com um agente oxidante como ácido crômico, peróxido de hidrogênio ou uma mistura de ácido nítrico e ácido sulfúrico. A reação ocorre em um ambiente ácido e a metiletilcetona resultante é separada da mistura reacional por destilação.
O método de condensação aldólica envolve a reação da acetona com 2-propanol na presença de uma base forte como hidróxido de sódio ou hidróxido de potássio. A reação produz uma mistura de metiletilcetona e outros subprodutos, que são separados por destilação.
Outro método de síntese envolve a reação de acetona com formaldeído na presença de um catalisador como ácido sulfúrico ou ácido p-toluenossulfônico. Esta reação produz uma mistura de metiletilcetona, formaldeído e outros subprodutos, que são separados por destilação.
No geral, a síntese de metiletilcetona requer um controle cuidadoso das condições de reação para garantir a produção de um produto de alta qualidade com o mínimo de subprodutos. É importante seguir as precauções de segurança adequadas ao trabalhar com os produtos químicos e reações envolvidas na síntese da metiletilcetona.
Usos da butanona
A butanona, também conhecida como metiletilcetona, tem uma ampla gama de utilizações industriais devido à sua solvência, volatilidade e baixo ponto de ebulição. Alguns dos usos mais comuns da butanona incluem:
- Solvente: Metil etil cetona é usada como solvente para diversas substâncias, como resinas, adesivos, tintas, decapantes, tintas de impressão, lacas de nitrocelulose e borrachas sintéticas.
- Agente de limpeza: A indústria eletrônica o utiliza como agente de limpeza para limpar peças e superfícies metálicas de graxa, óleo e outros contaminantes.
- Produtos farmacêuticos: Na indústria farmacêutica, a metiletilcetona é utilizada como solvente na produção de vacinas, antibióticos e outros medicamentos.
- Revestimentos: Revestimentos para madeira, papel e outros materiais também utilizam metiletilcetona como solvente em sua produção, bem como na fabricação de vernizes, lacas e outros revestimentos protetores.
- Perfumes: As indústrias cosmética e alimentícia utilizam metiletilcetona como solvente para perfumes e aromatizantes.
- Adesivos: Adesivos e selantes também utilizam metiletilcetona como solvente em sua produção.
Além de seus usos industriais, a metiletilcetona também tem sido estudada por seu potencial como combustível. Seu alto conteúdo energético e baixa toxicidade em comparação com outros combustíveis fazem dele uma fonte alternativa de energia promissora.
Questões:
Qual será a seguinte reação? 2-butanona + catalisador h2/ni
A reação da 2-butanona com gás hidrogênio sobre um catalisador de níquel é conhecida como reação de hidrogenação. Esta reação dará o seguinte produto:
2-butanona + H2 -> 2-butanol
A redução da ligação dupla entre os átomos de carbono e oxigênio no grupo cetona da 2-butanona resulta na formação de 2-butanol pela ativação do gás hidrogênio por um catalisador de níquel. A indústria química comumente utiliza essa reação para produzir 2-butanol, um solvente valioso e matéria-prima para outras produções químicas. O controle cuidadoso da temperatura, pressão e tipo de catalisador é necessário para a hidrogenação eficiente e seletiva de 2-butanona em 2-butanol.
2 butanona é uma cetona?
A química orgânica caracteriza a 2-butanona, também conhecida como metiletilcetona, como um tipo de cetona com um grupo carbonila (C = O) ligado a um átomo de carbono dentro de uma cadeia de hidrocarboneto. O grupo carbonila da 2-butanona reside entre dois átomos de carbono, daí seu rótulo “metil etil cetona”.
Qual é o espectro infravermelho da 2-butanona?
O espectro IR (infravermelho) da 2-butanona (também conhecida como metiletilcetona) pode fornecer informações importantes sobre sua estrutura molecular e grupos funcionais. O espectro IR da 2-butanona geralmente mostra as seguintes bandas principais de absorção:
- Alongamento da carbonila: Esta banda aparece como um pico agudo entre 1700 e 1700 cm^-1 e é característica do grupo funcional C=O da cetona.
- Estiramento alquil: Os picos entre 2.900 e 3.000 cm^-1 correspondem às vibrações de estiramento dos grupos CH2 e CH3 na 2-butanona.
- Flexão CH: Os picos entre 1400 e 1500 cm^-1 correspondem às vibrações de flexão das ligações CH na 2-butanona.
- Flexão COC: O pico entre 1300 e 1400 cm^-1 corresponde às vibrações de flexão do grupo COC em 2-butanona.
É importante notar que o espectro IR da 2-butanona será influenciado pela preparação da amostra e pelos instrumentos utilizados, bem como pela presença de impurezas ou contaminantes.
