Le propylène (C3H6) est un gaz incolore et inflammable couramment utilisé dans la production de plastiques et de fibres synthétiques. Il est également utilisé comme combustible dans les chalumeaux de soudage et de coupage.
| Nom de l’UICPA | Propène |
| Formule moléculaire | C3H6 |
| Numero CAS | 115-07-1 |
| Synonymes | Propylène, méthyléthylène, prop-1-ène, méthyléthylène |
| InChI | InChI=1S/C3H6/c1-3-2/h3H,1-2H3 |
Propriétés du propylène
Formule de propylène
La formule chimique du propylène est C3H6. Cela signifie que chaque molécule de propylène contient trois atomes de carbone et six atomes d’hydrogène. La formule est importante dans les réactions chimiques car elle indique le nombre et les types d’atomes présents dans chaque molécule. La formule du propylène est souvent utilisée dans la production de plastiques, de fibres synthétiques et d’autres matériaux industriels.
Propylène Masse molaire
Le propène, également appelé propène, a une masse molaire de 42,08 g/mol. Cela signifie qu’une mole de molécules de propène pèse 42,08 grammes. La masse molaire est importante dans les calculs chimiques car elle nous permet de faire la conversion entre la masse et les moles d’une substance. Pour calculer la masse molaire du propène, on additionne les masses atomiques de ses atomes constitutifs : trois atomes de carbone, chacun d’une masse de 12,01 amu, et six atomes d’hydrogène, chacun d’une masse de 1,01 amu.
Point d’ébullition du propylène
Le point d’ébullition du propène est de -47,6 °C (-53,7 °F). Cela signifie qu’à pression atmosphérique normale, le propène bout et se transforme en gaz à -47,6 °C. Le point d’ébullition est une propriété physique importante du propène car il détermine les conditions dans lesquelles la substance passera d’un liquide à un gaz. Le faible point d’ébullition du propène le rend utile comme réfrigérant et dans la production de produits chimiques.
Propylène Point de fusion
Le propène n’a pas de point de fusion bien défini car il subit une transition progressive d’un solide à un liquide lorsqu’il est chauffé. Cependant, la plage de fusion du propène est d’environ -185 à -135 °C (-301 à -211 °F). Cela signifie que le propène commencera à fondre à environ -185 °C et fondra complètement à environ -135 °C. Le point de fusion est important pour déterminer les conditions dans lesquelles le propène passera d’un solide à un liquide.
Densité du propylène g/mL
La densité du propène est de 0,74 g/mL à température ambiante (25 °C). Cela signifie qu’un millilitre de propène pèse 0,74 gramme. La densité est une propriété physique importante du propène car elle permet de déterminer la masse d’un volume donné de la substance. La faible densité du propène le rend utile dans les applications où un matériau léger est requis.
Propylène Poids moléculaire
Le poids moléculaire du propène est de 42,08 g/mol. Cette valeur est la somme des poids atomiques de tous les atomes d’une seule molécule de propène. Le poids moléculaire est une propriété importante car il nous permet de calculer la quantité d’une substance en moles à partir de sa masse ou vice versa.
Structure en propylène
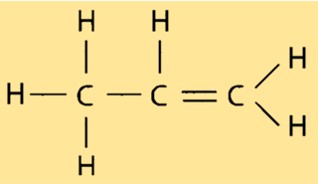
Le propène a une structure moléculaire linéaire, chaque atome de carbone étant lié à deux atomes d’hydrogène et à un autre atome de carbone. La double liaison entre les deux atomes de carbone confère au propène sa nature réactive et le rend utile dans diverses applications industrielles. La structure du propène est importante pour déterminer ses propriétés, telles que son point d’ébullition et son point de fusion.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,97 |
| Couleur | Incolore |
| Odeur | Odeur légèrement sucrée, semblable à celle de l’essence |
| Masse molaire | 42,08 g/mole |
| Densité | 0,74 g/mL (à 25 °C) |
| Point de fusion | -185 à -135 °C (-301 à -211 °F) |
| Point d’ébullition | -47,6 °C (-53,7 °F) |
| Point d’éclair | -108 °C (-162 °F) |
| Solubilité dans l’eau | 0,075 g/100 ml (à 20 °C) |
| Solubilité | Soluble dans l’acétone, l’éthanol, l’éther |
| Pression de vapeur | 50,6 kPa (à 25 °C) |
| Densité de vapeur | 1,45 (par rapport à l’air) |
| pKa | 44 |
| pH | Sans objet (le propylène n’est ni acide ni basique) |
Sécurité et dangers du propylène
Le propène est généralement considéré comme un composé relativement sûr à manipuler, mais il présente certains dangers. Il est hautement inflammable et peut s’enflammer facilement. Il doit donc être stocké et manipulé à l’écart des sources d’inflammation. Le contact avec la peau ou les yeux peut provoquer une irritation, et l’inhalation de concentrations élevées de propène peut provoquer des étourdissements et même une perte de conscience. Comme pour tout produit chimique, il est important de suivre les procédures de sécurité appropriées lors de la manipulation du propène, comme porter des équipements de protection comme des gants et des lunettes et assurer une ventilation adéquate. En cas d’exposition ou d’ingestion accidentelle, consulter immédiatement un médecin.
| Symboles de danger | Facilement inflammable (F+) |
| Description de la sécurité | Tenir à l’écart des sources d’ignition. Utiliser dans des zones bien ventilées. |
| Numéros d’identification de l’ONU | ONU 1077 |
| Code SH | 2901.10.00 |
| Classe de danger | 2.1 (gaz inflammable) |
| Groupe d’emballage | groupe A |
| Toxicité | Non considéré comme toxique |
Méthodes de synthèse du propylène
Diverses méthodes peuvent synthétiser le propène, notamment le vapocraquage des hydrocarbures, la déshydrogénation du propane et le craquage catalytique fluide.
Le vapocraquage est la méthode de synthèse du propène la plus courante. Cela implique le chauffage de matières premières d’hydrocarbures, telles que l’éthane, le propane ou le naphta, à des températures élevées en présence de vapeur. Le processus consiste à refroidir et à séparer le mélange d’hydrocarbures résultant pour isoler le propène en tant que produit distinct.
La déshydrogénation du propane est une autre méthode de synthèse du propène. Cela implique la réaction du propane avec un catalyseur pour éliminer l’hydrogène et produire du propène. Cette méthode est intéressante car le propane est facilement disponible et peu coûteux.
Le processus de craquage catalytique fluide utilise un catalyseur pour transformer les hydrocarbures lourds en produits plus légers, notamment le propène, en décomposant les molécules les plus grosses en molécules plus petites.
Utilisations du propylène
Le propène est un produit chimique polyvalent qui a de nombreuses utilisations dans diverses industries. Voici quelques-unes des utilisations les plus courantes du propène :
- Production de polypropylène : joue un rôle crucial en tant que matière première principale dans la production de polypropylène, un matériau polyvalent utilisé dans diverses applications, telles que l’emballage, les textiles et les pièces automobiles.
- Carburant : utilisé comme carburant dans de nombreuses applications industrielles, telles que l’oxycoupage et le soudage.
- Solvant : sert de solvant utile pour une variété de produits chimiques et les gens l’utilisent dans de nombreuses applications, y compris l’extraction d’huiles essentielles.
- Réfrigérant : utilisé comme réfrigérant dans certains systèmes, en particulier dans les applications où l’utilisation d’autres réfrigérants est restreinte.
- Intermédiaire chimique : utilisé comme intermédiaire chimique dans la production de nombreux autres produits chimiques, tels que l’oxyde de propylène, l’acrylonitrile et le butyraldéhyde.
- Emballage alimentaire : utilisé dans la production de matériaux d’emballage alimentaire, tels que des films et des contenants.
- Produits de soins personnels : de nombreux produits de soins personnels, tels que les crèmes hydratantes et les produits de soins capillaires, utilisent du propylène glycol, un dérivé du propène.
Des questions:
Q : Quelle réaction faut-il utiliser pour convertir le propène en halogénure d’alkyle ?
R : Le propène peut être converti en halogénure d’alkyle en utilisant une réaction avec des halogénures d’hydrogène, tels que le chlorure d’hydrogène (HCl) ou le bromure d’hydrogène (HBr).
Q : Quelle est la formule empirique du propène (c3h6) ?
R : La formule empirique du propène (C3H6) est CH2.
Q : Le propène est-il soluble dans l’eau ?
R : Le propène n’est pas soluble dans l’eau car c’est un composé non polaire et l’eau est un solvant polaire.
Q : Quelles sont les masses de formule du propène, C3H6 ?
R : La masse de formule du propène (C3H6) est d’environ 42,08 g/mol.
Q : Quelle est la formule empirique de la formule moléculaire suivante : C3H6 ?
R : La formule empirique de C3H6 est CH2.
Q : Comment pourriez-vous montrer expérimentalement que la formule moléculaire du propène est C3H6, et non CH2 ?
R : Une méthode expérimentale pour déterminer la formule moléculaire du propène consiste à analyser ses produits de combustion. Si le propène est brûlé dans un excès d’oxygène, les produits seront du dioxyde de carbone et de l’eau. En mesurant les quantités de dioxyde de carbone et d’eau produites, la formule moléculaire du propène peut être déterminée comme étant C3H6 plutôt que CH2.
