La pipéridine est une amine cyclique constituée d’un cycle à six chaînons avec un atome d’azote. Il est utilisé dans les produits pharmaceutiques, les pesticides et comme solvant pour les réactions organiques.
| Nom UICPA | Pipéridine |
| Formule moléculaire | C₅H₁₁N |
| Numero CAS | 110-89-4 |
| Synonymes | Hexahydropyridine, Azacyclohexane, Cyclopentimine |
| InChI | InChI=1S/C5H11N/c1-2-4-6-5-3-1/h6H,1-5H2 |
Propriétés de la pipéridine
Formule pipéridine
La formule chimique de l’hexahydropyridine est C₅H₁₁N. Il se compose de cinq atomes de carbone, onze atomes d’hydrogène et un atome d’azote. La formule représente la composition exacte des éléments dans une molécule d’hexahydropyridine.
Pipéridine Masse molaire
La masse molaire de l’hexahydropyridine est calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour l’hexahydropyridine (C₅H₁₁N), la masse molaire est d’environ 85,15 grammes par mole. Cette valeur est utile pour déterminer la quantité d’hexahydropyridine dans un échantillon donné.
Pipéridine Point d’ébullition
L’hexahydropyridine a un point d’ébullition d’environ 106 degrés Celsius. Cette température représente le point auquel la forme liquide de l’hexahydropyridine se transforme en gaz. Le point d’ébullition est important dans divers procédés industriels impliquant l’utilisation d’hexahydropyridine.
Pipéridine Point de fusion
Le point de fusion de l’hexahydropyridine est d’environ -7 degrés Celsius. Il indique la température à laquelle l’hexahydropyridine solide passe à l’état liquide. Le point de fusion est une caractéristique cruciale pour la manipulation et le stockage de l’hexahydropyridine dans différentes applications.
Pipéridine Densité g/mL
La densité de l’hexahydropyridine est d’environ 0,86 gramme par millilitre (g/mL). La densité fait référence à la masse d’une substance par unité de volume. Cette propriété est précieuse pour déterminer la quantité d’hexahydropyridine requise pour des applications spécifiques.
Pipéridine Poids moléculaire
Le poids moléculaire de l’hexahydropyridine est d’environ 85,15 grammes par mole. Il représente la somme des poids atomiques de tous les atomes présents dans une molécule d’hexahydropyridine. Le poids moléculaire est un paramètre essentiel utilisé dans divers calculs chimiques et réactions impliquant l’hexahydropyridine.
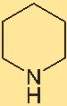
Structure de la pipéridine
L’hexahydropyridine a une structure cyclique constituée d’un cycle à six chaînons contenant un atome d’azote et cinq atomes de carbone. La disposition des atomes dans cette structure affecte les propriétés chimiques et le comportement de l’hexahydropyridine. Comprendre la structure permet d’étudier sa réactivité et ses interactions.
Solubilité de la pipéridine
L’hexahydropyridine est soluble dans l’eau et les solvants organiques. Il forme des liaisons hydrogène avec les molécules d’eau en raison de la présence d’un atome d’azote. La solubilité de l’hexahydropyridine lui permet d’être utilisée comme solvant dans divers procédés chimiques et comme réactif en synthèse organique.
| Apparence | Liquide transparent |
| Gravité spécifique | 0,862 g/ml |
| Couleur | Incolore |
| Odeur | Fort, ammoniacal |
| Masse molaire | 85,15 g/mole |
| Densité | 0,862 g/ml |
| Point de fusion | -7 °C |
| Point d’ébullition | 106 °C |
| Point d’éclair | 9 °C |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans les solvants polaires tels que l’eau et les solvants organiques |
| Pression de vapeur | 7,4 mmHg à 25 °C |
| Densité de vapeur | 2,95 (air=1) |
| pKa | 11.24 |
| pH | Basique |
Sécurité et dangers de la pipéridine
L’hexahydropyridine présente plusieurs risques pour la sécurité et doit être manipulée avec prudence. Il est irritant pour la peau, les yeux et le système respiratoire. Le contact direct peut provoquer des brûlures ou des irritations. L’inhalation de vapeurs d’hexahydropyridine peut entraîner une gêne respiratoire et des lésions pulmonaires. Il est inflammable et peut former des mélanges explosifs avec l’air. Lorsqu’il est chauffé, il peut dégager des fumées toxiques, notamment des oxydes d’azote. Une ventilation adéquate et des équipements de protection individuelle, tels que des gants et des lunettes, sont nécessaires lorsque l’on travaille avec l’hexahydropyridine. De plus, il doit être stocké dans un endroit frais et bien ventilé, à l’écart des sources d’ignition. Une formation appropriée et une connaissance des protocoles de sécurité sont essentielles pour manipuler l’hexahydropyridine afin de minimiser les risques potentiels.
| Symboles de danger | Crâne et os croisés, flamme, corrosif |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Tenir à l’écart des sources d’inflammation. |
| Numéros d’identification de l’ONU | No ONU 2879 (pour la Pipéridine) |
| Code SH | 2933.99.80 |
| Classe de danger | Classe 6.1 (Substances toxiques) |
| Groupe d’emballage | Groupe d’emballage II |
| Toxicité | La pipéridine est toxique et peut avoir des effets graves sur la santé. L’inhalation, l’ingestion ou l’absorption cutanée doivent être évitées. Une exposition prolongée ou répétée peut entraîner des lésions organiques ou des problèmes respiratoires. Des mesures de protection appropriées doivent être prises pendant la manipulation et le stockage. |
Méthodes de synthèse de pipéridine
Il existe différentes méthodes de synthèse de l’hexahydropyridine.
Une méthode couramment utilisée implique la réaction du 1,5-dihalopentane avec l’ammoniac . Dans ce processus, le groupe amino (-NH2) remplace les atomes d’halogène en subissant une substitution nucléophile. Une autre méthode implique la réduction de la pyridine avec de l’hydrogène gazeux sur un catalyseur, tel que le palladium ou le platine. Cette réaction de réduction convertit la pyridine en hexahydropyridine en ajoutant deux atomes d’hydrogène à l’atome d’azote.
De plus, l’hydrogénation de sels de pyridinium ou de dérivés de pyridine donne de l’hexahydropyridine. Ce processus d’hydrogénation se produit sous haute pression et température à l’aide d’un catalyseur approprié. Une autre approche implique la réaction du 2,5-diméthylpyrrole avec l’acétylène suivie d’une hydrogénation, qui donne de l’hexahydropyridine.
Par ailleurs, l’amination réductrice de la cyclopentanone ou de ses dérivés avec de l’ammoniac ou des amines primaires peut également conduire à la formation d’hexahydropyridine. Cette réaction implique l’ajout d’un groupe amino au groupe cétone, suivie d’une réduction pour former le cycle hexahydropyridine.
Dans l’ensemble, ces méthodes de synthèse permettent d’obtenir de l’hexahydropyridine à partir de diverses matières premières, permettant sa production dans différents contextes industriels et de recherche. Le choix de la méthode dépend de facteurs tels que la disponibilité des matières premières, le rendement souhaité et les exigences spécifiques de l’application.
Utilisations de la pipéridine
L’hexahydropyridine a plusieurs applications dans diverses industries en raison de ses propriétés polyvalentes. Certaines utilisations courantes de l’hexahydropyridine comprennent :
- Industrie pharmaceutique : L’industrie pharmaceutique utilise l’hexahydropyridine comme élément de base pour synthétiser de nombreux composés pharmaceutiques. Il joue un rôle crucial dans la production de médicaments tels que les antihistaminiques, les antipsychotiques, les analgésiques et les agents antiviraux.
- Produits agrochimiques : L’hexahydropyridine améliore l’efficacité des pesticides et des insecticides, car les fabricants l’utilisent dans leur production. Il améliore le contrôle des ravageurs et améliore les rendements des cultures.
- Synthèse organique : L’hexahydropyridine agit comme catalyseur ou solvant dans les réactions organiques, facilitant les processus de condensation, de cyclisation et d’oxydation. Il permet la synthèse de divers composés chimiques.
- Industrie du caoutchouc : Dans l’industrie du caoutchouc, l’hexahydropyridine fonctionne comme un accélérateur de vulcanisation. Il améliore la résistance mécanique, l’élasticité et la durabilité des produits en caoutchouc en améliorant la réticulation des polymères de caoutchouc.
- Solvant : L’hexahydropyridine sert de solvant pour divers composés organiques, ce qui la rend utile dans les processus d’extraction, les réactions chimiques et comme milieu pour la formulation pharmaceutique. Il dissout une large gamme de substances.
- Inhibiteur de corrosion : L’hexahydropyridine fonctionne comme un inhibiteur de corrosion, protégeant les surfaces métalliques de la dégradation. Il forme un film protecteur sur le métal, ralentissant ou empêchant les réactions de corrosion.
- Réactif de laboratoire : Les chercheurs utilisent l’hexahydropyridine comme réactif dans des expériences de laboratoire, notamment en chimie organique. Il participe activement aux réactions, telles que les N-alkylations et les réactions d’ouverture de cycle, facilitant la synthèse des composés souhaités.
- Intermédiaires chimiques : les dérivés de l’hexahydropyridine servent d’intermédiaires dans la production de divers produits chimiques, notamment des colorants, des parfums et des tensioactifs.
Ces applications démontrent les rôles divers et précieux que joue l’hexahydropyridine dans de multiples industries, contribuant au développement de produits pharmaceutiques, de produits agrochimiques, de produits en caoutchouc, etc.
Des questions:
Q : Quel est le pKa de la pipéridine ?
R : Le pKa de l’hexahydropyridine est d’environ 11,24.
Q : Quel est le pKa du malonate de diéthyle ?
R : Le pKa du malonate de diéthyle est d’environ 12,5.
Q : Pourquoi l’acide conjugué de la morpholine est-il plus acide que l’acide conjugué de la pipéridine ?
R : L’acide conjugué de la morpholine est plus acide en raison de la présence d’un atome d’oxygène attracteur d’électrons dans le cycle morpholine, qui stabilise la charge positive de l’acide conjugué.
Q : Comment éliminer l’adduit dibenzofulvène-pipéridine ?
R : L’adduit dibenzofulvène-pipéridine peut être éliminé par des techniques de purification appropriées telles que l’extraction par solvant, la chromatographie ou la recristallisation, en fonction des conditions spécifiques et de la pureté souhaitée.
Q : Quel est le rôle de la pipéridine dans la réaction que vous avez effectuée ?
R : L’hexahydropyridine peut agir comme catalyseur, base ou réactif, selon les conditions et exigences spécifiques de la réaction.
Q : La pipéridine est-elle miscible au THF ?
R : Oui, l’hexahydropyridine est miscible au THF (tétrahydrofurane).
Q : Que se passe-t-il lorsque la pipéridine et le DMF sont associés ?
R : Lorsque l’hexahydropyridine et le DMF (diméthylformamide) sont combinés, ils peuvent potentiellement subir diverses réactions en fonction des conditions de réaction et de la présence d’autres réactifs ou catalyseurs.
Q : Quel est le pH d’une solution qui est de 0,120 M en pipéridine et de 0,079 M dans son sel chlorure ?
R : Le pH de la solution dépendrait du pKa de l’hexahydropyridine et de la dissociation de son sel chlorure, et nécessiterait des calculs supplémentaires pour déterminer la valeur exacte du pH.
Q : Comment briser l’anneau pipéridine ?
R : La rupture du cycle hexahydropyridine peut être obtenue par diverses méthodes telles que des réactions d’oxydation, de réduction ou d’ouverture de cycle, en utilisant des réactifs et des conditions de réaction appropriées.
Q : Basicité de la pyridine ou de la pipéridine ?
R : L’hexahydropyridine est généralement plus basique que la pyridine en raison de la présence d’un atome d’azote plus nucléophile dans son cycle, ce qui la rend plus facilement capable de donner un proton.
