Le phosphate trisodique (Na3PO4) est un composé composé d’ions sodium et phosphate. Il a diverses utilisations dans les industries telles que l’alimentation, les produits pharmaceutiques et les détergents, pour sa capacité à contrôler l’acidité et à agir comme tampon.
| Nom UICPA | Phosphate trisodique |
| Formule moléculaire | Na3PO4 |
| Numero CAS | 7601-54-9 |
| Synonymes | phosphate de sodium, TSP, orthophosphate de sodium, phosphate de sodium tribasique, phosphate tertiaire de sodium, orthophosphate trisodique |
| InChI | InChI=1S/3Na.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Propriétés du phosphate trisodique
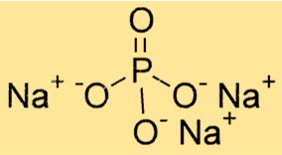
Formule de phosphate trisodique
La formule chimique du phosphate trisodique est Na3PO4. Il se compose de trois cations sodium (Na+) et d’un anion phosphate (PO43-). La formule est importante pour déterminer la stœchiométrie des réactions chimiques et pour calculer la quantité d’une substance dans une quantité donnée.
Phosphate trisodique Masse molaire
La masse molaire de Na3PO4 est de 163,94 g/mol. Il est calculé en additionnant les masses atomiques de ses éléments constitutifs, qui sont le sodium, le phosphore et l’oxygène. La masse molaire est un paramètre important utilisé pour déterminer la quantité d’une substance dans une quantité donnée. Il est également utilisé pour calculer la stœchiométrie des réactions chimiques.
Phosphate trisodique Point d’ébullition
Le point d’ébullition du Na3PO4 est de 1 587 °C. C’est la température à laquelle l’état liquide passe à l’état gazeux. Le point d’ébullition d’une substance dépend de divers facteurs, tels que la pression, la température et les forces intermoléculaires. Le point d’ébullition élevé du Na3PO4 est dû à sa nature ionique et à ses fortes forces intermoléculaires.
Phosphate trisodique Point de fusion
Le point de fusion du Na3PO4 est de 1 340 °C. C’est la température à laquelle une substance solide passe à l’état liquide. Le point de fusion d’une substance dépend de divers facteurs, tels que la pression, la température et les forces intermoléculaires. Le point de fusion élevé du Na3PO4 est dû à sa nature ionique et à ses fortes forces intermoléculaires.
Phosphate trisodique Densité g/ml
La densité de Na3PO4 est de 2,54 g/ml. La densité est la mesure de la masse d’une substance par unité de volume. Il s’agit d’une propriété physique importante d’une substance utilisée pour déterminer sa masse ou son volume. La haute densité de Na3PO4 est due à sa nature ionique et à ses particules serrées.
Phosphate trisodique Poids moléculaire
Le poids moléculaire de Na3PO4 est de 163,94 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire de Na3PO4 est important pour déterminer la stœchiométrie des réactions chimiques et pour calculer la quantité d’une substance dans une quantité donnée.
Structure du phosphate trisodique
Na3PO4 a une structure cristalline avec un arrangement hexagonal d’atomes serrés. Les cations sodium sont situés dans les interstices des anions oxygène compacts. L’anion phosphate est constitué d’un atome de phosphore et de quatre atomes d’oxygène, disposés en forme tétraédrique.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,536 g/cm3 |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 163,94 g/mole |
| Densité | 2,54 g/ml |
| Point de fusion | 1 340 °C |
| Point d’ébullition | 1 587 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et insoluble dans les solvants organiques |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | pKa1 = 2,15, pKa2 = 7,20, pKa3 = 12,35 |
| pH | pH de la solution 0,1 M = 11,5 |
Sécurité et dangers du phosphate trisodique
Na3PO4 est généralement considéré comme sûr pour une utilisation dans les aliments, les produits pharmaceutiques et d’autres applications. Cependant, comme tout produit chimique, il peut présenter des dangers s’il est mal manipulé. L’ingestion de grandes quantités de Na3PO4 peut entraîner des problèmes gastro-intestinaux tels que diarrhée, nausées et vomissements. Le contact des yeux et de la peau avec la substance peut provoquer des irritations et des brûlures. Il est important de manipuler le Na3PO4 avec précaution, de porter un équipement de protection individuelle approprié et de suivre toutes les procédures de sécurité lorsque vous travaillez avec cette substance. En cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin.
| Symboles de danger | Aucun |
| Description de la sécurité | Utiliser avec une ventilation adéquate. Évitez tout contact avec la peau et les yeux. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 28352200 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité. L’ingestion de grandes quantités peut provoquer des problèmes gastro-intestinaux. Peut provoquer une irritation et des brûlures au contact de la peau et des yeux. |
Méthodes de synthèse du phosphate trisodique
Il existe plusieurs méthodes de synthèse de Na3PO4, notamment la réaction de l’hydroxyde de sodium avec l’acide phosphorique , la réaction du carbonate de sodium avec l’acide phosphorique et la réaction du chlorure de sodium avec l’acide phosphorique en présence de carbonate de sodium.
Une méthode courante implique la réaction de l’hydroxyde de sodium (NaOH) avec l’acide phosphorique (H3PO4) . Cette réaction produit du Na3PO4 (Na3PO4) et de l’eau (H2O). L’équation chimique équilibrée de cette réaction est :
3 NaOH + H3PO4 → Na3PO4 + 3 H2O
Une autre méthode implique la réaction du carbonate de sodium (Na2CO3) avec l’acide phosphorique (H3PO4) . Cette réaction produit du Na3PO4 (Na3PO4), du dioxyde de carbone (CO2) et de l’eau (H2O). L’équation chimique équilibrée de cette réaction est :
Na2CO3 + 2 H3PO4 → 2 Na3PO4 + 3 CO2 + 3 H2O
Une troisième méthode implique la réaction du chlorure de sodium (NaCl) avec l’acide phosphorique (H3PO4) en présence de carbonate de sodium (Na2CO3) . Cette réaction produit du Na3PO4 (Na3PO4), du chlorure de sodium (NaCl), du dioxyde de carbone (CO2) et de l’eau (H2O). L’équation chimique équilibrée de cette réaction est :
3 NaCl + H3PO4 + Na2CO3 → Na3PO4 + 3 NaCl + 3 CO2 + 3 H2O
Les industries utilisent largement ces méthodes pour produire du Na3PO4 pour diverses applications.
Utilisations du phosphate trisodique
Na3PO4 a de nombreuses utilisations dans diverses industries en raison de ses propriétés uniques. Certaines utilisations courantes du Na3PO4 sont :
- Industrie alimentaire : utilisé comme additif alimentaire pour améliorer la texture, la saveur et la durée de conservation des produits alimentaires transformés.
- Industrie pharmaceutique : utilisée dans la production de divers produits pharmaceutiques, notamment des laxatifs, des antiacides et des solutions électrolytiques.
- Traitement de l’eau : Utilisé dans les processus de traitement de l’eau pour contrôler la formation de tartre et prévenir la corrosion dans les systèmes de distribution d’eau.
- Industrie des détergents : Utilisé dans la production de détergents pour améliorer leurs propriétés nettoyantes.
- Agriculture : Utilisé comme engrais et amendement du sol en agriculture pour fournir des nutriments essentiels aux plantes.
- Applications industrielles : Utilisé dans divers processus industriels, notamment le traitement des surfaces métalliques, la production de céramique et comme ignifuge.
- Applications en laboratoire : utilisé dans diverses applications de laboratoire, notamment la purification de l’ADN et des protéines, les solutions tampons et comme régulateur de pH.
Des questions:
Q : Le Na3PO4 est-il soluble dans l’eau ?
R : Oui, Na3PO4 est hautement soluble dans l’eau.
Q : Quelle est la concentration molaire des ions sodium dans une solution de Na3PO4 0,350 M ?
R : Dans une solution de Na3PO4 0,350 M, la concentration molaire en ions sodium est de 1,05 M.
Q : Na3PO4 est-il un acide ou une base ?
R : Na3PO4 est un sel basique.
Q : Quelle est l’équation ionique nette de la réaction entre des solutions aqueuses de Na3PO4 et CuSO4 ?
R : L’équation ionique nette de la réaction entre les solutions aqueuses de Na3PO4 et CuSO4 est : 2Na+(aq) + Cu2+(aq) + 2PO43-(aq) + SO42-(aq) → Cu3(PO4)2(s) + 2Na+ (aq) + SO42-(aq).
Q : Quel volume d’une solution de Na3PO4 à 3,50 M devez-vous utiliser pour préparer 1,50 L d’une solution de Na3PO4 à 2,55 M ?
R : Pour préparer une solution de Na3PO4 à 2,55 M en utilisant une solution de Na3PO4 à 3,50 M, vous devrez utiliser 0,921 L de la solution à 3,50 M.
Q : Qu’est-ce que le phosphate trisodique ?
R : Le phosphate trisodique est un sel inorganique de sodium et de phosphate de formule chimique Na3PO4.
Q : Le phosphate trisodique est-il soluble ?
R : Oui, le phosphate trisodique est hautement soluble dans l’eau.
Q : Comment savoir si une poudre blanche que vous avez est du bicarbonate de sodium ou du phosphate trisodique ?
R : Une façon de différencier le bicarbonate de sodium du Na3PO4 consiste à effectuer un simple test de pH. Le bicarbonate de sodium est basique et donnera un pH supérieur à 7, tandis que Na3PO4 est neutre et donnera un pH de 7.
Q : Quelle est la formule du phosphate trisodique ?
R : La formule du phosphate trisodique est Na3PO4.
